
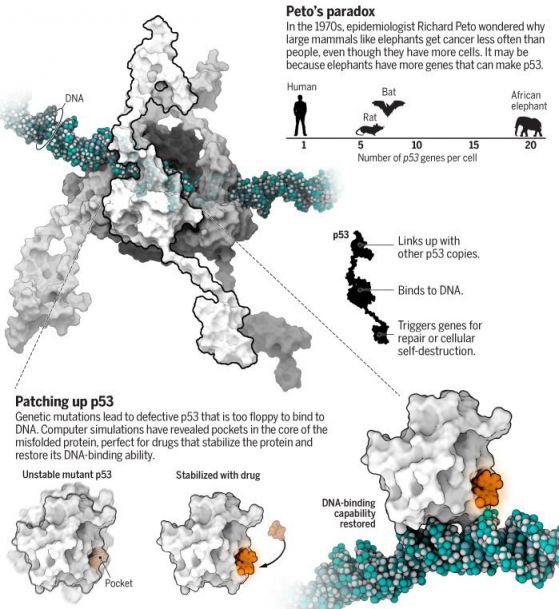
–Я–Њ—З—В–Є –љ–µ–≤—К–Ј–Љ–Њ–ґ–љ–Њ –µ –і–∞ —Б–µ —А–∞–Ј–≥–ї–µ–і–∞ –і–Њ–±—А–µ –≤ –і–µ–є—Б—В–≤–Є–µ –ї—О–±–Є–Љ–Є—П—В –њ—А–Њ—В–µ–Є–љ –љ–∞ –†–Њ–Љ–Є –Р–Љ–∞—А–Њ (Rommie Amaro) вАУ –±–Є–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–Ї –≤ –Ъ–∞–ї–Є—Д–Њ—А–љ–Є–є—Б–Ї–Є—П —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В –≤ –°–∞–љ –Ф–Є–µ–≥–Њ. –Я—А–Њ—В–µ–Є–љ—К—В p53 –∞–ї–∞—А–Љ–Є—А–∞, –Ј–∞ –і–∞ —Б–µ —Г–љ–Є—Й–Њ–ґ–∞—В –Ї–ї–µ—В–Ї–Є —Б –њ–Њ–≤—А–µ–і–∞ –љ–∞ –Ф–Э–Ъ –Є —В–∞–Ї–∞ –≥–Є —Б–њ–Є—А–∞ –і–∞ –љ–µ —Б—В–∞–љ–∞—В —А–∞–Ї–Њ–≤–Є вАУ –µ–і–љ–∞ –њ—А–Є—З–Є–љ–∞ –њ–Њ—А–∞–і–Є –Ї–Њ—П—В–Њ –µ –љ–∞—А–µ—З–µ–љ вАЮ–њ–∞–Ј–∞—З—К—В –љ–∞ –≥–µ–љ–Њ–Љ–∞вАЭ. –Э–Њ —В–Њ–є –µ –≥–Њ–ї—П–Љ –Є –≥—К–≤–Ї–∞–≤ вАУ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–µ–љ —И–µ–є–њ—И–Є—Д—В—К—А (–≥–Њ–ї—П–Љ –њ—А–Њ—В–µ–Є–љ —Б –њ—А–Њ–Љ–µ–љ–ї–Є–≤–∞ —Б—В—А—Г–Ї—В—Г—А–∞), –Ї–Њ–є—В–Њ –µ —В—А—Г–і–љ–Њ –і–∞ –±—К–і–µ —Б–ї–µ–і–µ–љ —Б—К—Б —Б—В–∞–љ–і–∞—А—В–љ–Є —Б—А–µ–і—Б—В–≤–∞ –Ј–∞ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ. –Ґ–∞–Ї–∞ —З–µ –Р–Љ–∞—А–Њ —Б–µ –µ –Њ–±—К—А–љ–∞–ї–∞ –Ї—К–Љ —Б—Г–њ–µ—А–Ї–Њ–Љ–њ—О—В—А–Є—В–µ. –Ґ—П —Б–µ –µ –Ј–∞–і—К–ї–±–Њ—З–Є–ї–∞ –≤ –љ–Њ–≤–Є —А–µ–љ—В–≥–µ–љ–Њ–≤–Є —Б–љ–Є–Љ–Ї–Є –љ–∞ —Д—А–∞–≥–Љ–µ–љ—В–Є –љ–∞ p53 –Є –і–Њ–њ—К–ї–љ–Є–ї–∞ –њ—А–Њ–≥—А–∞–Љ–∞—В–∞ —Б–Є, –Ј–∞ –і–∞ –љ–∞–њ—А–∞–≤–Є —Д–Є–ї–Љ –љ–∞ –≤–Є–±—А–Є—А–∞—Й–∞—В–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В –љ–∞ –≤—Б–µ–Ї–Є –Њ—В 1.6 –Љ–Є–ї–Є–Њ–љ–∞ –∞—В–Њ–Љ–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞ –Ј–∞ —Ж—П–ї–∞ –Љ–Є–Ї—А–Њ—Б–µ–Ї—Г–љ–і–∞ вАУ –≤–µ—З–љ–Њ—Б—В –≤ –∞—В–Њ–Љ–µ–љ –Љ–∞—Й–∞–±. –У–µ–љ–µ—А–Є—А–∞–љ–µ—В–Њ –љ–∞ —В–Њ–Ј–Є —Д–Є–ї–Љ –Њ—В–љ–µ–Љ–∞ –Њ–Ї–Њ–ї–Њ –Љ–µ—Б–µ—Ж –њ—А–Њ—Ж–µ—Б–Њ—А–љ–Њ –≤—А–µ–Љ–µ –љ–∞ —Б—Г–њ–µ—А–Ї–Њ–Љ–њ—О—В—К—А–∞. –Ґ—П –љ–∞–±–ї—О–і–∞–≤–∞ —З–µ—В–Є—А–Є –Ї–Њ–њ–Є—П –љ–∞ p53, —Б–≤—К—А–Ј–∞–љ–Є –Є —Г–≤–Є—В–Є –Њ–Ї–Њ–ї–Њ –≤–µ—А–Є–≥–∞ –Ф–Э–Ъ, –Ї–Њ–µ—В–Њ –њ—А–Њ—В–µ–Є–љ–∞ –њ—А–∞–≤–Є –њ—А–µ–і–Є –і–∞ –Є–Ј–њ—А–∞—В–Є —Б—К–Њ–±—Й–µ–љ–Є—П –Ј–∞ –Ї–ї–µ—В—К—З–љ–Њ —Б–∞–Љ–Њ—Г–љ–Є—Й–Њ–ґ–µ–љ–Є–µ.
–Р–Љ–∞—А–Њ –љ–µ —Б–µ –Є–љ—В–µ—А–µ—Б—Г–≤–∞ —Б–∞–Љ–Њ –Њ—В –њ–Њ–≤–µ–і–µ–љ–Є–µ—В–Њ –љ–∞ –Ј–і—А–∞–≤ p53, —В—П –Є—Б–Ї–∞ –Є –і–∞ —А–∞–Ј–±–µ—А–µ –µ—Д–µ–Ї—В–Є—В–µ –љ–∞ –Љ—Г—В–∞—Ж–Є–Є—В–µ, –Ї—К–Љ –Ї–Њ–Є—В–Њ –≥–µ–љ–∞ –Ј–∞ p53 –µ —Б–Ї–ї–Њ–љ–µ–љ. –Ґ—П –Є –Ї–Њ–ї–µ–≥–Є—В–µ —Э —Б–∞ –љ–∞–њ—А–∞–≤–Є–ї–Є —Б–Є–Љ—Г–ї–∞—Ж–Є–Є, —З—А–µ–Ј –Ї–Њ–Є—В–Њ –њ—А–Њ—Б–ї–µ–і—П–≤–∞—В –Ї–Њ–ї–Ї–Њ —З–µ—Б—В–Њ —Б—А–µ—Й–∞–љ–Є –Љ—Г—В–∞—Ж–Є–Є –љ–∞ p53 –і–Њ–њ—К–ї–љ–Є—В–µ–ї–љ–Њ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–Є—А–∞—В –≤–µ—З–µ –≥—К–≤–Ї–∞–≤–Є—П –њ—А–Њ—В–µ–Є–љ, —А–∞–Ј–Ї—А–Є–≤—П–≤–∞—В –≥–Њ –Є —Б–њ–Є—А–∞—В —Б–≤—К—А–Ј–≤–∞–љ–µ—В–Њ –Љ—Г —Б –Ф–Э–Ъ. –Э—П–Ї–Њ–Є —Б–Є–Љ—Г–ї–∞—Ж–Є–Є —Б—К—Й–Њ —В–∞–Ї–∞ —А–∞–Ј–Ї—А–Є–≤–∞—В –љ–µ—Й–Њ –і—А—Г–≥–Њ вАУ –Њ—Б–љ–Њ–≤–∞ –Ј–∞ –Ї–Њ—П—В–Њ –і–∞ —Б–µ –Ј–∞–і—К—А–ґ–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї–љ–Њ –ї–µ–Ї–∞—А—Б—В–≤–Њ. –Ю—В –≤—А–µ–Љ–µ –љ–∞ –≤—А–µ–Љ–µ —Б–µ –Њ—Д–Њ—А–Љ—П –Љ–∞–ї—К–Ї –њ—А–Њ—Ж–µ–њ –≤ —Б—К—А—Ж–µ–≤–Є–љ–∞—В–∞ –љ–∞ –Љ—Г—В–Є—А–∞–ї–Є—П –њ—А–Њ—В–µ–Є–љ. –Ъ–Њ–≥–∞—В–Њ –Р–Љ–∞—А–Њ –њ—А–Є–±–∞–≤—П –≤–Є—А—В—Г–∞–ї–љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–Є –Љ–Њ–ї–µ–Ї—Г–ї–Є –њ—А–Є —Б–≤–Њ–Є—В–µ –Љ–Њ–і–µ–ї–Є, —Б—К–µ–і–Є–љ–µ–љ–Є—П—В–∞ —Б–µ –Ј–∞–±–Є–≤–∞—В –≤ —В–∞–Ј–Є —Ж–µ–њ–љ–∞—В–Є–љ–∞, —Б—В–∞–±–Є–ї–Є–Ј–Є—А–∞–є–Ї–Є p53 –і–Њ—Б—В–∞—В—К—З–љ–Њ, —З–µ –і–∞ –њ—А–Њ–і—К–ї–ґ–Є —Б–≤–Њ–Є—В–µ –љ–Њ—А–Љ–∞–ї–љ–Є —Д—Г–љ–Ї—Ж–Є–Є.

–°—В—А—Г–Ї—В—Г—А–∞—В–∞ –љ–∞ –∞–Ї—В–Є–≤–љ–∞—В–∞ –Ј–Њ–љ–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞ —А53 (–≤ —Б–≤–µ—В–ї–Њ —Б–Є–љ—М–Њ), —Б–≤—К—А–Ј–∞–љ–∞ –Ї—К–Љ –Ф–Э–Ъ (—В—К–Љ–љ–Њ—Б–Є–љ—М–Њ). –Т –ґ—К–ї—В–Њ —Б–∞ –љ–∞–є-—З–µ—Б—В–Њ –Љ—Г—В–Є—А–∞—Й–Є—В–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–µ–ї–Є–љ–Є –≤ —З–Њ–≤–µ—И–Ї–Є—В–µ —А–∞–Ї–Њ–≤–Є –Ј–∞–±–Њ–ї—П–≤–∞–љ–Є—П, –∞ –≤ —З–µ—А–≤–µ–љ–Њ вАУ —Ж–Є–љ–Ї–Њ–≤ –∞—В–Њ–Љ.
–Ш–Ј—В–Њ—З–љ–Є–Ї: https://www.ncbi.nlm.nih.gov/books/NBK22268/
–Ч–∞ –Р–Љ–∞—А–Њ –Є –љ—П–Ї–Њ–Є –і—А—Г–≥–Є –Є–Ј—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —В–µ–Ј–Є –Ї–Њ–Љ–њ—О—В—К—А–љ–Є —Б—В–Є–Љ—Г–ї–∞—Ж–Є–Є —Б–∞ –≤–і—К—Е–љ–Њ–≤–µ–љ–Є–µ. вАЮ–Ф—К–ї–≥–Њ–≥–Њ–і–Є—И–љ–∞ –Љ–µ—З—В–∞ –љ–∞ —А–∞–Ї–Њ–≤–∞—В–∞ –±–Є–Њ–ї–Њ–≥–Є—П –µ –і–∞ –Њ—В–Ї—А–Є–µ —Б—К–µ–і–Є–љ–µ–љ–Є—П –Њ—В –Љ–∞–ї–Ї–Є –Љ–Њ–ї–µ–Ї—Г–ї–Є, –Ј–∞ –і–∞ –≤—К–Ј—Б—В–∞–љ–Њ–≤–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—В–∞ –љ–∞ p53. –Э–Є–µ —Б–Љ–µ –Љ–љ–Њ–≥–Њ —А–∞–Ј–≤—К–ї–љ—Г–≤–∞–љ–Є –Њ—В —В–Њ–≤–∞вАЭ вАУ –Ї–∞–Ј–≤–∞ –Р–Љ–∞—А–Њ.
–Ю—В –±–ї–Є–Ј–Њ 1.7 –Љ–Є–ї–Є–Њ–љ–∞ —З–Њ–≤–µ–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є—Ж–Є—А–∞–љ–Є —Б —А–∞–Ї –≤—Б—П–Ї–∞ –≥–Њ–і–Є–љ–∞, —Б–∞–Љ–Њ –≤ –°–Р–©, –Њ–Ї–Њ–ї–Њ –њ–Њ–ї–Њ–≤–Є–љ–∞—В–∞ –Є–Љ–∞—В –Љ—Г—В–Є—А–∞–ї–Є –≤–∞—А–Є–∞–љ—В–Є –љ–∞ p53 вАУ –Ј–љ–∞–Ї –Ї–Њ–ї–Ї–Њ –≤–∞–ґ–µ–љ –µ –љ–Њ—А–Љ–∞–ї–љ–Є—П –њ—А–Њ—В–µ–Є–љ –≤ –њ—А–µ–і–Њ—В–≤—А–∞—В—П–≤–∞–љ–µ—В–Њ –љ–∞ –±–Њ–ї–µ—Б—В—В–∞. –Ґ–Њ–є –µ –µ–і–Є–љ –Њ—В –љ–∞–є-–Є–љ—В–µ–љ–Ј–Є–≤–љ–Њ –Є–Ј—Г—З–∞–≤–∞–љ–Є—В–µ –њ—А–Њ—В–µ–Є–љ–Є –≤ –љ–∞—Г–Ї–∞—В–∞ –Є –љ–∞–є-—В—К—А—Б–µ–љ–Є—В–µ —Ж–µ–ї–Є –Ј–∞ —Б—К–Ј–і–∞—В–µ–ї–Є—В–µ –љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–∞. –Я–Њ-–≥–Њ–ї—П–Љ–∞—В–∞ —З–∞—Б—В –Њ—В –Љ–∞–ї–Ї–Њ—В–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ —Б–∞ —Б—К–Ј–і–∞–і–µ–љ–Є –і–∞ —Г–≤–µ–ї–Є—З–∞–≤–∞—В –±—А–Њ—П –љ–∞ –Ј–і—А–∞–≤–Є p53. –Ш –≤—К–њ—А–µ–Ї–Є –і–µ—Б–µ—В–Є–ї–µ—В–Є—П—В–∞ —Г—Б–Є–ї–Є—П, –љ–Є–Ї–Њ–µ –љ–µ –µ —Б—В–Є–≥–љ–∞–ї–Њ –і–Њ –њ–∞–Ј–∞—А–∞.
–†–∞–±–Њ—В–∞—В–∞ –љ–∞ –Р–Љ–∞—А–Њ –њ–Њ–Ї–∞–Ј–≤–∞ –Ї–∞–Ї –≥—А—Г–њ–Є—З–Ї–∞ –∞–Ї–∞–і–µ–Љ–Є—З–љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Є –Љ–∞–ї–Ї–Є –Ї–Њ–Љ–њ–∞–љ–Є–Є –Є–Љ–∞—В –љ–∞–њ—А–µ–і—К–Ї —Б –љ–Њ–≤ –њ–Њ–і—Е–Њ–і –љ–∞—Б–Њ—З–µ–љ –Ї—К–Љ p53: –і–∞ —Б–µ —Б–њ–∞—Б–Є, –Ї–Њ–≥–∞—В–Њ –µ –±–Њ–ї–µ–љ. –Ґ–µ –Њ—В–Ї—А–Є–≤–∞—В –ї–µ–Ї–∞—А—Б—В–≤–∞, –Ї–Њ–Є—В–Њ —Б–µ —Б–≤—К—А–Ј–≤–∞—В –Є –њ–Њ–і–і—К—А–ґ–∞—В –Ї–Њ–њ–Є—П—В–∞ –љ–∞ –Љ—Г—В–Є—А–∞–ї p53, –≤—К–Ј—Б—В–∞–љ–Њ–≤—П–≤–∞–є–Ї–Є –љ–µ–≥–Њ–≤–∞—В–∞ —Д–Њ—А–Љ–∞ –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В –і–∞ –≤—К—А—И–Є —Б–≤–Њ—П—В–∞ —А–∞–±–Њ—В–∞. –Х–і–љ–Њ —В–∞–Ї–Њ–≤–∞ –ї–µ–Ї–∞—А—Б—В–≤–Њ –≤–µ—З–µ –µ –њ—А–µ–Љ–Є–љ–∞–ї–Њ —А–∞–љ–љ–∞ —Д–∞–Ј–∞ –љ–∞ –Є–Ј–њ–Є—В–∞–љ–Є—П –њ—А–Є —Е–Њ—А–∞—В–∞ –Є –µ –≤—К–≤ —Д–∞–Ј–∞ –љ–∞ –њ–Њ-–љ–∞–њ—А–µ–і–љ–∞–ї–Є –Ї–ї–Є–љ–Є—З–љ–Є –Њ–њ–Є—В–Є. –Ф—А—Г–≥–Є –±—К–і–µ—Й–Є –ї–µ–Ї–∞—А—Б—В–≤–∞ —Б–µ –њ—А–Є–±–ї–Є–ґ–∞–≤–∞—В –і–Њ —З–Њ–≤–µ—И–Ї–Є —В–µ—Б—В–Њ–≤–µ. –Р–Ї–Њ —Г—Б–њ–µ—П—В –њ—А–Є –Ї–ї–Є–љ–Є—З–љ–∞—В–∞ –њ—А–∞–Ї—В–Є–Ї–∞, —В–µ –Љ–Њ–ґ–µ —Б–µ—А–Є–Њ–Ј–љ–Њ –і–∞ –њ—А–Њ–Љ–µ–љ—П—В –њ–µ–є–Ј–∞–ґ–∞ –Ј–∞ —А–∞–Ї–Њ–≤–Њ—В–Њ –ї–µ—З–µ–љ–Є–µ, —Б—К—Й–Њ –Є –Ј–∞ –і—А—Г–≥–Є –Ј–∞–±–Њ–ї—П–≤–∞–љ–Є—П, –Ї–Њ–Є—В–Њ –≤–Ї–ї—О—З–≤–∞—В –љ–µ–њ—А–∞–≤–Є–ї–љ–Њ –љ–∞–≥—К–љ–∞—В–Є –њ—А–Њ—В–µ–Є–љ–Є, –≤–Ї–ї—О—З–Є—В–µ–ї–љ–Њ –Є –Р–ї—Ж—Е–∞–є–Љ–µ—А.
–Ъ–ї–∞—Б –Т–Є–Љ–∞–љ (Klas Wiman) вАУ —В—Г–Љ–Њ—А–µ–љ –Ї–ї–µ—В—К—З–µ–љ –±–Є–Њ–ї–Њ–≥ –≤ –Є–љ—Б—В–Є—В—Г—В–∞ вАЮ–Ъ–∞—А–Њ–ї–Є–љ—Б–Ї–∞вАЭ –≤ –°—В–Њ–Ї—Е–Њ–ї–Љ, —В–≤—К—А–і–Є —З–µ –≤—К–Ј—Б—В–∞–љ–Њ–≤—П–≤–∞–љ–µ—В–Њ –љ–∞ –љ–Њ—А–Љ–∞–ї–љ–∞—В–∞ —Д—Г–љ–Ї—Ж–Є—П –љ–∞ –Љ—Г—В–Є—А–∞–ї –њ—А–Њ—В–µ–Є–љ –µ –њ–Њ-—В—А—Г–і–љ–Њ –Њ—В —В–Њ–≤–∞ –њ—А–Њ—Б—В–Њ –і–∞ —Б–µ –±–ї–Њ–Ї–Є—А–∞, –Ї–Њ–µ—В–Њ –µ –Є —Б—В—А–∞—В–µ–≥–Є—П—В–∞ –Є–Ј–њ–Њ–ї–Ј–≤–∞–љ–∞ –Њ—В –њ–Њ–≤–µ—З–µ—В–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є —В–µ—А–∞–њ–Є–Є. –Ъ–∞—В–Њ —А–µ–Ј—Г–ї—В–∞—В –≥–Њ–ї–µ–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–Є –Ї–Њ–Љ–њ–∞–љ–Є–Є —Б–µ –Њ—В–і—А—К–њ–≤–∞—В –Њ—В —Б–њ–∞—Б–Є—В–µ–ї–љ–∞—В–∞ —Б—В—А–∞—В–µ–≥–Є—П –Є –њ—А–Њ–≥—А–µ—Б—К—В –µ –±–∞–≤–µ–љ. вАЮ–Э–µ –µ –∞–Ї—В—Г–∞–ї–љ–Њ –Ј–∞ –≥–Њ–ї–µ–Љ–Є—В–µ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–љ–Є –Ї–Њ–Љ–њ–∞–љ–Є–Є.вАЭ
–Э–Њ —В–∞–Ј–Є —Б—В—А–∞—В–µ–≥–Є—П –Љ–Њ–ґ–µ –і–∞ –і–∞–і–µ –Љ–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї–љ–Є —А–µ–Ј—Г–ї—В–∞—В–Є. –Ґ—П –љ–µ —Б–∞–Љ–Њ –ї–µ–Ї—Г–≤–∞ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –≤–Є–і–Њ–≤–µ —А–∞–Ї, –љ–Њ —Б –Љ–∞–ї–Ї–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –Є –њ–Њ-—Б–њ–µ—Ж–Є–∞–ї–љ–Њ –Ї–Њ–≥–∞—В–Њ –µ –Ї–Њ–Љ–±–Є–љ–Є—А–∞–љ–∞ —Б —Е–µ–Љ–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–љ–Є –ї–µ–Ї–∞—А—Б—В–≤–∞, –њ—А–Є—З–Є–љ—П–≤–∞—Й–Є –Ї–ї–µ—В—К—З–љ–∞ –њ–Њ–≤—А–µ–і–∞ –≤ —В—Г–Љ–Њ—А–∞. –Ъ–ї–µ—В—К—З–љ–∞—В–∞ –њ–Њ–≤—А–µ–і–∞ –∞–Ї—В–Є–≤–Є—А–∞ p53. –Ь—Г—В–∞—Ж–Є–Є—В–µ –≤ p53 —Б–∞ —Б–Ї–ї–Њ–љ–љ–Є –і–∞ —Б–µ –љ–∞—В—А—Г–њ–≤–∞—В –≤ —Б—К—А—Ж–µ–≤–Є–љ–∞—В–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞, –Ї—К–і–µ—В–Њ —Б–µ —Б–≤—К—А–Ј–≤–∞—В –Ї—К–Љ –Ф–Э–Ъ –Є –њ—А–Њ–Љ–µ–љ—П—В —Д–Њ—А–Љ–∞—В–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞, –Ї–Њ–µ—В–Њ –≥–Њ –∞–Ї—В–Є–≤–Є—А–∞.
–Р–ї—К–љ –§—К—А—И—В, —Е–Є–Љ–Є–Ї –≤ –Ъ–µ–є–Љ–±—А–Є–і–ґ–Ї–Є—П —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В, –њ—А–µ–і–њ–Њ–ї–∞–≥–∞, —З–µ –ї–µ–Ї–∞—А—Б—В–≤–∞—В–∞ –≤—К–Ј—Б—В–∞–љ–Њ–≤—П–≤–∞—Й–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—В–∞ –љ–∞ p53, —А–∞–±–Њ—В—П—В –љ–µ —Б–∞–Љ–Њ —Б –µ–і–љ–∞ –Љ—Г—В–Є—А–∞–ї–∞ —Д–Њ—А–Љ–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞, –∞ —Б –Љ–љ–Њ–≥–Њ. –Ґ–Њ–≤–∞ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Є–і–≤–∞ –Њ—В –Ї–ї–µ—В—К—З–љ–Є—В–µ –Њ–њ–Є—В–Є –Є –Є–Ј—Б–ї–µ–і–≤–∞–љ–Є—П –≤—К—А—Е—Г –ґ–Є–≤–Њ—В–љ–Є.
–Ф–Њ—Б—В–∞ –њ–Њ-–Ї—К—Б–љ–Њ —Б–ї–µ–і –Њ—В–Ї—А–Є–≤–∞–љ–µ—В–Њ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞ –њ—А–µ–Ј 1979, —Г—З–µ–љ–Є—В–µ –Њ—Б—К–Ј–љ–∞–≤–∞—В –Љ–∞–≥–Є—З–µ—Б–Ї–Є—В–µ —Б–Є–ї–Є –љ–∞ p53 –і–∞ –њ–Њ—В–Є—Б–Ї–∞ —В—Г–Љ–Њ—А–Є—В–µ. –Т –љ–∞—З–∞–ї–Њ—В–Њ —Б–µ –µ —Б—З–Є—В–∞–ї–Њ, —З–µ –µ –Њ–љ–Ї–Њ–≥–µ–љ, —Б–њ–Њ—Б–Њ–±–µ–љ –і–∞ –њ—А–µ–≤—К—А–љ–µ –Ї–ї–µ—В–Ї–∞—В–∞ –≤ —А–∞–Ї–Њ–≤–∞ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є –Њ–±—Б—В–Њ—П—В–µ–ї—Б—В–≤–∞. –°–∞–Љ–Њ –і–µ—Б–µ—В–Є–ї–µ—В–Є–µ –њ–Њ-–Ї—К—Б–љ–Њ –µ –њ–Њ—В–≤—К—А–і–µ–љ–Њ, —З–µ —А53 —Б–µ —Б–≤—К—А–Ј–≤–∞ –Ї—К–Љ –Ф–Э–Ъ –Є –≤–Ї–ї—О—З–≤–∞ –µ–Ї—Б–њ—Аe—Б–Є—П—В–∞ –љ–∞ –і—А—Г–≥–Є –≥–µ–љ–Є, –Ї–Њ–Є—В–Њ —Б–∞ –љ–∞—Б–Њ—З–µ–љ–Є –Ї—К–Љ –ї–µ—З–µ–љ–Є–µ—В–Њ –љ–∞ –Ї–ї–µ—В—К—З–љ–∞—В–∞ –њ–Њ–≤—А–µ–і–∞. –Р–Ї–Њ —Б–µ –Њ–Ї–∞–ґ–µ, —З–µ —В–∞–Ј–Є –њ–Њ–≤—А–µ–і–∞ –µ –Є–Ј–≤—К–љ –≤—К–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є—В–µ –љ–∞ –і—А—Г–≥–Є —В—Г–Љ–Њ—А-—Б—Г–њ—А–µ—Б–Њ—А–љ–Є –≥–µ–љ–Є, –Ї–Њ–Є—В–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–∞—В —Б p53, —В—П –≥–Њ –љ–∞—Б–Њ—З–≤–∞ –Ї—К–Љ —Б—В–∞—А—В–Є—А–∞–љ–µ –љ–∞ –≤–µ—А–Є–≥–∞—В–∞ –Ј–∞ –њ—А–Њ–≥—А–∞–Љ–Є—А–∞–љ–∞ –Ї–ї–µ—В—К—З–љ–∞ —Б–Љ—К—А—В.
–Ш–Ј–≤–µ—Б—В–љ–Њ –µ, —З–µ —В–Њ–Ј–Є –њ—А–Њ—В–µ–Є–љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–∞ –Є –Ї–Њ–љ—В—А–Њ–ї–Є—А–∞ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —А–∞–Ј–ї–Є—З–љ–Є –≥–µ–љ–Є –Є –њ—А–Њ—В–µ–Є–љ–Є. –Ґ–Њ–є —Б—К—Й–Њ –њ–Њ–Љ–∞–≥–∞ –Ј–∞ —А–µ–≥—Г–ї–∞—Ж–Є—П—В–∞ –љ–∞ —Ж–Є–Ї—К–ї–∞ –љ–∞ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Є—В–µ —Б—К–±–Є—В–Є—П, —З—А–µ–Ј –Ї–Њ–є—В–Њ –Ї–ї–µ—В–Ї–Є—В–µ —А–∞—Б—В–∞—В –Є —Б–µ —А–∞–Ј–Љ–љ–Њ–ґ–∞–≤–∞—В. –Ч–∞—А–∞–і–Є –≥–Њ–ї—П–Љ–Њ—В–Њ —Б–Є –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ–≥–Њ–≤–Њ—В–Њ –њ—А–Є—Б—К—Б—В–≤–Є–µ –≤ –Ї–ї–µ—В–Ї–∞—В–∞ –µ —Б—В—А–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–∞–љ–Њ. –Ф—А—Г–≥ –њ—А–Њ—В–µ–Є–љ вАУ MDM2 —Б–µ –Ј–∞—Е–≤–∞—Й–∞ –Ј–∞ –Љ–Њ–ї–µ–Ї—Г–ї–Є p53 –Є –≥–Є —Г–љ–Є—Й–Њ–ґ–∞–≤–∞, –Ј–∞–њ–∞–Ј–≤–∞–є–Ї–Є —В—П—Е–љ–Њ—В–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–∞ –љ–µ –њ—А–µ–≤–Є—И–∞–≤–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –љ–Є–≤–Њ.
–Э–Њ —В–Њ–Ј–Є –Ї–Њ–љ—В—А–Њ–ї–µ–љ –Љ–µ—Е–∞–љ–Є–Ј—К–Љ —Б–µ –њ—А–Њ–≤–∞–ї—П –≤ –Љ–љ–Њ–≥–Њ —Б–ї—Г—З–∞–Є. –Ч–∞ –љ–∞—З–∞–ї–Њ –Ї–Њ–≥–∞—В–Њ p53 –µ –Љ—Г—В–Є—А–∞–ї, MDM2 –љ–µ –Љ–Њ–ґ–µ –і–∞ –≥–Њ –∞—В–∞–Ї—Г–≤–∞. –Ъ–∞—В–Њ —А–µ–Ј—Г–ї—В–∞—В –љ–µ–Є–Ј–њ—А–∞–≤–љ–Є—П –њ—А–Њ—В–µ–Є–љ —Б–µ –љ–∞—В—А—Г–њ–≤–∞ –≤ –Ї–ї–µ—В–Ї–Є—В–µ –љ–µ–Њ–±–µ–Ј–њ–Њ–Ї–Њ—П–≤–∞–љ –Є –њ—А–µ—З–Є –љ–∞ –Њ—Б—В–∞–≤–∞—Й–Є—В–µ –Ј–і—А–∞–≤–Є p53 –і–∞ —Б–Є –≤—К—А—И–∞—В —А–∞–±–Њ—В–∞—В–∞. –Р–Ї–Њ –њ–∞–Ј–∞—З—К—В –љ–∞ –≥–µ–љ–Њ–Љ–∞ –љ–µ –µ –љ–∞ —Б–≤–Њ—П –њ–Њ—Б—В, –њ—А–µ–і—А–∞–Ї–Њ–≤–Є—В–µ –Ї–ї–µ—В–Ї–Є –Њ—Ж–µ–ї—П–≤–∞—В –Є —Б–µ –≤—К–Ј–њ—А–Њ–Є–Ј–≤–µ–ґ–і–∞—В. –Ґ–Њ–≤–∞ –Є–Љ –і–∞–≤–∞ –≤—К–Ј–Љ–Њ–ґ–љ–Њ—Б—В –і–∞ –љ–∞—В—А—Г–њ–≤–∞—В –і–Њ–њ—К–ї–љ–Є—В–µ–ї–љ–Є—В–µ –Љ—Г—В–∞—Ж–Є–Є, –Њ—В –Ї–Њ–Є—В–Њ —Б–µ –љ—Г–ґ–і–∞—П—В, –Ј–∞ –і–∞ —Б—В–∞–љ–∞—В –љ–∞–њ—К–ї–љ–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–Є.
–Ф—А—Г–≥–Є –њ–Њ–і—Е–Њ–і–Є –≤–Ї–ї—О—З–≤–∞—В —Г–≤–µ–ї–Є—З–∞–≤–∞–љ–µ –љ–∞ –љ–Є–≤–Њ—В–Њ –љ–∞ p53 –Є–ї–Є –љ–∞ —Б—К–µ–і–Є–љ–µ–љ–Є—П—В–∞, –Ї–Њ–Є—В–Њ –≤—К–Ј—Б—В–∞–љ–Њ–≤—П–≤–∞—В –љ–Њ—А–Љ–∞–ї–љ–∞—В–∞ —Д—Г–љ–Ї—Ж–Є—П –љ–∞ –Љ—Г—В–Є—А–∞–ї–Є—П –њ—А–Њ—В–µ–Є–љ, –љ–Њ –Њ–њ–Є—В–Є—В–µ –љ–µ —Б–∞ —Г—Б–њ–µ—И–љ–Є. –Я—А–µ–Ј 1998 –µ–Ї–Є–њ—К—В –љ–∞ –Т–Є–Љ–∞–љ –Є–Ј–њ—А–Њ–±–≤–∞—В 2000 —Б—К–µ–і–Є–љ–µ–љ–Є—П –Њ—В –±–Є–±–ї–Є–Њ—В–µ–Ї–∞ –≤ –Э–∞—Ж–Є–Њ–љ–∞–ї–љ–Є—П —А–∞–Ї–Њ–≤ –Є–љ—Б—В–Є—В—Г—В –љ–∞ –°–Р–© –Є –Њ—В–Ї—А–Є–≤–∞—В –і–≤–µ, –Ї–Њ–Є—В–Њ –Є–Ј–≥–ї–µ–ґ–і–∞ —З–µ –≤—К–Ј—Б—В–∞–љ–Њ–≤—П–≤–∞—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—В–∞ –љ–∞ –Љ—Г—В–∞–љ—В–љ–Є—П p53 –і–∞ —Г–±–Є–≤–∞ —А–∞–Ї–Њ–≤–Є –Ї–ї–µ—В–Ї–Є. –Х–і–љ–Њ—В–Њ вАУ MIRA-1 —Б–µ –Њ–Ї–∞–Ј–≤–∞ —В–Њ–Ї—Б–Є—З–љ–Њ –Ј–∞ –Љ–Є—И–Ї–Є, –љ–Њ –і—А—Г–≥–Њ—В–Њ вАУ PRIMA-1 –µ –њ–Њ-–Њ–±–µ—Й–∞–≤–∞—Й–Њ. –†–µ–Ј—Г–ї—В–∞—В–Є—В–µ –њ–Њ–Ї–∞–Ј–≤–∞—В, —З–µ —Б—К–µ–і–Є–љ–µ–љ–Є–µ—В–Њ –њ–Њ–Љ–∞–≥–∞ –љ–∞ –њ—А–Њ—В–µ–Є–љ–∞ –і–∞ —Б–µ –≤—К—А–љ–µ –њ–∞–Ї –≤ –љ–∞—З–∞–ї–љ–∞—В–∞ —Б–Є —Д–Њ—А–Љ–∞, –Ј–∞–њ–∞–Ј–≤–∞–є–Ї–Є –љ–µ–≥–Њ–≤–∞—В–∞ —Д—Г–љ–Ї—Ж–Є—П. –Ы–µ–Ї–∞—А—Б—В–≤–Њ, —Б—К–Ј–і–∞–і–µ–љ–Њ –Њ—В —В–Њ–≤–∞ —Б—К–µ–і–Є–љ–µ–љ–Є–µ —Б–µ –љ–∞—А–Є—З–∞ APR-246 –Є –µ –≤—К–≤ –≤—В–Њ—А–∞ —Д–∞–Ј–∞ –љ–∞ –Ї–ї–Є–љ–Є—З–љ–Є—В–µ –Њ–њ–Є—В–Є –њ—А–Є –ґ–µ–љ–Є —Б —А–∞–Ї –љ–∞ —П–є—З–љ–Є—Ж–Є—В–µ, –њ—А–Є –Ї–Њ–є—В–Њ –њ–Њ—З—В–Є –≤–Є–љ–∞–≥–Є –Є–Љ–∞ –Љ—Г—В–∞—Ж–Є–Є –≤ p53. –Ъ–ї–Є–љ–Є—З–љ–Є—В–µ –Њ–њ–Є—В–Є –≤–µ—А–Њ—П—В–љ–Њ —Й–µ –±—К–і–∞—В –њ—А–Є–Ї–ї—О—З–µ–љ–Є –і–Њ 2 –≥–Њ–і–Є–љ–Є, –Ї–∞–Ј–≤–∞ –Ы–∞—А—И –Р–±—А–∞—Е–Љ—Б–µ–љ (Lars Abrahmsen), –≥–ї–∞–≤–љ–Є—П –љ–∞—Г—З–µ–љ —Б–µ–Ї—А–µ—В–∞—А –љ–∞ –Ї–Њ–Љ–њ–∞–љ–Є—П –Р–њ—А–µ–∞ –Р–Т (Aprea AB), –Ї–Њ–Љ–њ–∞–љ–Є—П—В–∞ –Ї–Њ–Љ–µ—А—Б–Є–∞–ї–Є–Ј–Є—А–∞—Й–∞ –ї–µ–Ї–∞—А—Б—В–≤–Њ—В–Њ.
–Э–Њ –Љ–Њ–ґ–µ –±–Є –љ–∞–є-–Љ–∞—Й–∞–±–љ–∞—В–∞ —Ж–µ–ї –љ–∞ —В–Њ–Ј–Є –њ–Њ–і—Е–Њ–і —Й–µ –µ –і–∞ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є–Љ —В—Г–Љ–Њ—А–Є—В–µ –і–∞ —Б–µ –њ–Њ—П–≤—П–≤–∞—В –Є–Ј–Њ–±—Й–Њ. –Т–Є–Љ–∞–љ –њ–Њ–і—З–µ—А—В–∞–≤–∞, —З–µ –љ–∞—Б—В–Њ—П—Й–Є—В–µ —В–µ—Е–љ–Є–Ї–Є –Ј–∞ –Ї—А—К–≤–µ–љ —Б–Ї—А–Є–љ–Є–љ–≥ –Љ–Њ–ґ–µ –≤–µ—З–µ –і–∞ —А–∞–Ј–Ї—А–Є—П—В –і–∞–ї–Є —З–Њ–≤–µ–Ї –Њ—В–і–µ–ї—П —Б–≤—К—А–Ј–∞–љ–Є —Б —А–∞–Ї–∞ –њ—А–Њ—В–µ–Є–љ–Є –≤ —Б–≤–Њ–µ—В–Њ –Ї—А—К–≤–Њ–Њ–±—А—К—Й–µ–љ–Є–µ, –і–Њ—А–Є –њ—А–µ–і–Є –і–∞ –њ–Њ–Ї–∞–Ј–≤–∞—В –њ—А–Є–Ј–љ–∞—Ж–Є –љ–∞ –љ–∞–њ—К–ї–љ–Њ —А–∞–Ј–≤–Є—В —В—Г–Љ–Њ—А.
–Э—П–Ї–Њ–є –і–µ–љ –Љ–Њ–ґ–µ –і–∞ –µ –≤—К–Ј–Љ–Њ–ґ–љ–Њ –і–∞ –і–∞–і–µ–Љ –љ–∞ —Е–Њ—А–∞—В–∞ —Б —В–∞–Ї–Є–≤–∞ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–≤–∞—Й–Є –Ј–љ–∞—Ж–Є –ї–µ–Ї–∞—А—Б—В–≤–∞, –Ї–Њ–Є—В–Њ —Б–њ–∞—Б—П–≤–∞—В p53, –і–∞–≤–∞–є–Ї–Є —Б–Є–≥–љ–∞–ї –љ–∞ —В–µ—Е–љ–Є—В–µ –Ї–ї–µ—В—К—З–љ–Є –њ–∞–Ј–Є—В–µ–ї–Є –і–∞ –≤–љ–Є–Љ–∞–≤–∞—В –Є –њ—А–µ–Љ–∞—Е–≤–∞—В —А–∞–Ї–∞ –њ—А–µ–і–Є –і–∞ –µ –Ј–∞–њ–Њ—З–љ–∞–ї.
–Ш–Ј—В–Њ—З–љ–Є–Ї:
This protein is mutated in half of all cancers. New drugs aim to fix it before itвАЩs too late, Robert F. Service
–Ю—Й–µ –њ–Њ —В–µ–Љ–∞—В–∞

–Ц–Є–≤–Њ—В—К—В
–Ф-—А –У–µ–Њ—А–≥–Є –Ь–Є–ї–Њ—И–µ–≤: –Я—А–µ–≤—А—К—Й–∞–љ–µ—В–Њ –љ–∞ –љ–∞—Г–Ї–∞—В–∞ –≤ –±–Є–Ј–љ–µ—Б —П —Г–љ–Є—Й–Њ–ґ–∞–≤–∞

–Ц–Є–≤–Њ—В—К—В
–Ґ–∞—Б–Љ–∞–љ–Є–є—Б–Ї–Є—В–µ –і—П–≤–Њ–ї–Є –µ–≤–Њ–ї—О–Є—А–∞—В, –Ј–∞ –і–∞ —Г—Б—В–Њ—П—В –љ–∞ —Б–Љ—К—А—В–Њ–љ–Њ—Б–µ–љ —А–∞–Ї

–Ц–Є–≤–Њ—В—К—В
–Ь–Є—И–Ї–Є —Б–∞ –Є–Ј–ї–µ–Ї—Г–≤–∞–љ–Є –Њ—В —А–∞–Ї —З—А–µ–Ј –≥–µ–љ–љ–Њ —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ. –°–Ї–Њ—А–Њ - —В–µ—Б—В–Њ–≤–µ –≤—К—А—Е—Г —Е–Њ—А–∞
















–Ъ–Њ–Љ–µ–љ—В–∞—А–Є
–Ь–Њ–ї—П, —А–µ–≥–Є—Б—В—А–Є—А–∞–є—В–µ —Б–µ –Њ—В T–£–Ъ!
–Р–Ї–Њ –≤–µ—З–µ –Є–Љ–∞—В–µ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—П, –љ–∞—В–Є—Б–љ–µ—В–µ –Ґ–£–Ъ!
–Э—П–Љ–∞ –Ї–Њ–Љ–µ–љ—В–∞—А–Є –Ї—К–Љ —В–∞–Ј–Є –љ–Њ–≤–Є–љ–∞ !
–Я–Њ—Б–ї–µ–і–љ–Є –Ї–Њ–Љ–µ–љ—В–∞—А–Є
YKoshev
–Я—А–µ—Б—В–Є–ґ–љ–∞ –љ–∞–≥—А–∞–і–∞ –Њ—В –С–Р–Э —Б–њ–µ—З–µ–ї–Є –≥–ї–∞–≤–љ–Є—П—В —А–µ–і–∞–Ї—В–Њ—А –љ–∞ –Э–∞—Г–Ї–∞OFFNews
Johnny B Goode
–Я—А–µ—Б—В–Є–ґ–љ–∞ –љ–∞–≥—А–∞–і–∞ –Њ—В –С–Р–Э —Б–њ–µ—З–µ–ї–Є –≥–ї–∞–≤–љ–Є—П—В —А–µ–і–∞–Ї—В–Њ—А –љ–∞ –Э–∞—Г–Ї–∞OFFNews
Gunteer
–Я—А–µ—Б—В–Є–ґ–љ–∞ –љ–∞–≥—А–∞–і–∞ –Њ—В –С–Р–Э —Б–њ–µ—З–µ–ї–Є –≥–ї–∞–≤–љ–Є—П—В —А–µ–і–∞–Ї—В–Њ—А –љ–∞ –Э–∞—Г–Ї–∞OFFNews
–•—А–Є—Б—В–Є—П–љ–Є–љ
–Ґ–Њ–≤–∞ –µ –Ї—А–∞–ї—П—В –љ–∞ —В–Є–Ї–≤–Є—В–µ: –Ґ–Є–Ї–≤–∞—В–∞ –Љ—Г —В–µ–ґ–Є –љ–∞–і –µ–і–Є–љ –µ–і–Є–љ —В–Њ–љ