
Клишето „ти си това, което ядеш“ се използва от стотици години, за да илюстрира връзката между храната и здравето. Сега международен екип от изследователи намери молекулярното доказателство за тази концепция, демонстрирайки как храната в крайна сметка влияе върху имунитета чрез чревната микробиома.
Изследването, проведено върху мишки, разкрива, че това, което животните консумират, инициира освобождаването на метаболитен страничен продукт от специфичен чревен микроб, който от своя страна модулира чревния имунитет на животните.
Констатациите, публикувани в Nature, предлагат обединяващо обяснение за сложното взаимодействие между храната, чревната микробиота и имунната функция. Те са резултат от сътрудничеството между учени от Медицинското училище на Харвард (Harvard Medical School), Brigham and Women's Hospital, Сеулския национален университет (Seoul National University) и Университета Монаш (Monash University), Австралия.
Експериментите определят микробна молекула, чийто синтез и освобождаване се влияят от храната на гостоприемника. Тази молекула от своя страна стимулира активирането и сигнализирането на подгрупа от клетки, известни като Т-клетки естествени убийци (NK - natural killer), които участват в имунната регулация и участват в редица възпалителни състояния.
Макар учените отдавна да предполагат, че храната играе роля за силата на имунитета, новото проучване изяснява точната молекулярна каскада зад това взаимодействие, коментира старшият автор на изследването Денис Каспър (Dennis Kasper), професор по имунология в Института Блаватник в Медицинското училище в Харвард.
Показахме как диетата влияе на имунната система чрез микробен медиатор в червата и това е наистина поразителен пример за триадата храна-микробиота-имунитет. Тази работа предоставя стъпка по стъпка пътя от началото до края, който обяснява как и защо работи тази триада и как храната в крайна сметка влияе на имунната система", обяснява професор Денис Каспър.
Ако се потвърдят при по-големи животни и в крайна сметка при хора, констатациите могат да помогнат за оформянето на дизайна на лечения с малки молекули, които подобряват както чревния, така и цялостния имунитет, коментират изследователите.
"Микробите, живеещи в червата, произвеждат молекули с огромно структурно разнообразие. Използвахме микробни и химически инструменти, за да изясним как тези молекули се синтезират от чревните бактерии и как действат в червата на гостоприемника", разказва първият автор на изследването Сунгван О (Sungwhan Oh), главен изследовател в Център за експериментална терапия и реперфузионни наранявания в Brigham and Women's Hospital и бивш постдокторант в лабораторията на Каспър."Нашите открития предоставят завладяващи прозрения за микробиома, храненето и имунната функция и дават интересни улики за това как молекулите, направени от нашите вътрешни съквартиранти, могат да се използва за проектиране на терапии".
 Bacteroides fragilis (зелена стрелка) се намира като агрегати върху епитела на дебелото черво. Кредит: Gregory Donaldson, Mark S Ladinsky et al.
Bacteroides fragilis (зелена стрелка) се намира като агрегати върху епитела на дебелото черво. Кредит: Gregory Donaldson, Mark S Ladinsky et al.
В серия от експерименти екипът идентифицира каскадата на имунни сигнали, предизвикана от метаболитното разграждане на хранителните аминокиселини в мишите черва. Този многоетапен път започва с храната, консумирана от животното, която съдържа аминокиселини с разклонена верига, наречени така за структурата, подобна на дървовидна клонка на една от техните молекулярни вериги. Аминокиселините с разклонена верига след това се поемат от B. fragilis, микроб, живеещ в червата, и се превръщат от специфичен ензим в захарно-липидни молекули, които също имат разклонени вериги. След това B. fragilis освобождава молекули с разклонена верига, които се забелязват и улавят от клас имунни сигнални клетки, известни като антиген-презентиращи клетки, които от своя страна индуцират NK Т-клетките да упражняват своя имунорегулаторен отговор чрез повишаване на контрола на възпалението на гените и имунорегулиращите химични вещества.
По-специално, експериментите показват, че разклонеността на структурата на веригата инициира каскадата.
Правоверижните версии на молекулата не дават същия ефект. Освен това, екипът установява, че B. fragilis променя структурата на молекулите на захарта и липидите, които метаболизира, и ги прави по-способни да се свързват с рецепторите на специфични имунни клетки и да инициират сигнална каскада, която завършва с намаляване на възпалението.
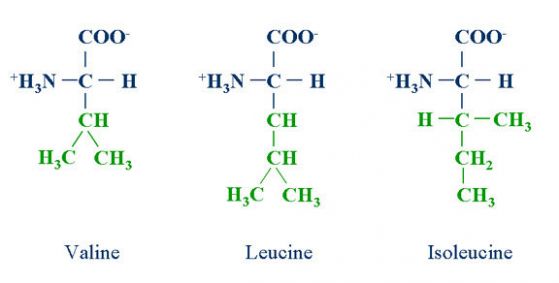 Структура на трите различни аминокиселини с разклонена верига. Кредит: Creative proteomics
Структура на трите различни аминокиселини с разклонена верига. Кредит: Creative proteomics
Работата също така показва, че всяка от трите различни аминокиселини с разклонена верига, консумирани от мишките, дава леко различни структурни промени на бактериалните липидни молекули, което води до различни модели на свързване с имунните клетки.
Изследователи от Националния университет в Сеул синтезират и екипът от Харвард тества 23 различни конфигурации на имуномодулаторната молекула, направена от микробите, за да определят как всяка от тях взаимодейства с имунните клетки, които регулират възпалението.
Регулиране на възпалението
Експериментите на екипа от Харвард разкриват, че синтетичните, лабораторно изработени липидни молекули с разклонена верига индуцират NK Т клетките да освобождават имуно-сигнализиращия химикал IL-2, докато лабораторните версии с права верига на тези молекули не го правят. Така активирани, NK Т клетките от своя страна индуцират експресията на гени, които регулират имунитета, но не и на гени, които предизвикват възпаление.
Използвайки подход на структурната биология, Джейми Росджон (Jamie Rossjohn), професор по биохимия и молекулярна биология от австралийския Университет Монаш, изяснява как липидната структура се ангажира и се свързва с антиген-презентиращи клетки - имунните клетки, които дават зелена светлина на NK T клетките за производство на противовъзпалителни химични вещества.
В последната стъпка изследователите лекуват мишки с улцерозен колит със захар-липидна молекула с разклонена верига. Животните, които са били лекувани с молекулата с разклонена верига, са се справили много по-добре от нетретираните животни. Те не само наддават на тегло, но когато учените изследват чревните клетки на мишките под микроскоп, те наблюдават, че тези клетки също имат минимални признаци на възпаление на дебелото черво.
Взети заедно, експериментите предоставят структурно и молекулярно обяснение на наблюдаваните по-рано противовъзпалителни ефекти на този клас захар-липиди, произведени от чревния микроб B. fragilis.
„Тази работа предлага чудесен пример за трансдисциплинарни изследвания, базирани на открития, насочени към отговор на основен въпрос в биомедицинските науки, а именно как имунната система може да бъде модулирана от взаимодействието между храната и микробиотата“, коментира Росджон.
През 2014 г. Каспър и колегите му публикуват проучване, което показва, че захар-липидната молекула, освободена от B. fragilis, има противовъзпалителни ефекти върху червата и предпазва мишките от колит, но учените не знаят как тези молекули се създават от микроба, нито специфичните структурни особености на захарните липиди, които придават противовъзпалителен ефект. Настоящото проучване отговаря на този въпрос, показвайки, че захар-липидните молекули, направени от този конкретен организъм, са с разклонена верига и точно тази структура с разклонена верига им позволява да се свързват с имунните клетки по начин, който намалява провъзпалителната сигнализация на тези клетки.
"Нашата нова работа показва, че разклоняването на липидната структура предизвиква много различен отговор - разклонението в структурата предизвиква противовъзпалителен, а не провъзпалителен отговор", отбелязва Каспър.
Констатациите дават надежда, че възпалителните заболявания, медиирани от тези NK Т клетки, могат един ден да бъдат лекувани с микробни молекули, потискащи възпалението, направени лабораторно, съобщават изследователите.
Точната функция на NK Т клетките - имунните клетки, които молекулата, направена от микроби, в крайна сметка активира, за да контролира възпалението на дебелото черво при мишки - не е добре разбрана, коментира Каспър. Но като се има предвид, че тези клетки покриват стомашно-чревния тракт и белите дробове на човека и се намират също в черния дроб и далака, те вероятно играят значителна роля в имунната регулация. Предишни изследвания сочат вероятното участие на тези клетки в редица възпалителни състояния, включително улцерозен колит, и възможна роля при възпалителни състояния на дихателните пътища като астма.
„Никога не можем да изолираме достатъчно от тези имуномодулиращи молекули от бактерии за терапевтична употреба, но красотата на това проучване е, че сега можем да ги синтезираме в лабораторията“, коментира Каспър. „Идеята би била, че ще имаме лекарство, което може да модулира възпалението в дебелото черво и извън него.
Справка: Oh, S.F., Praveena, T., Song, H. et al. Host immunomodulatory lipids created by symbionts from dietary amino acids. Nature (2021). doi.org/10.1038/s41586-021-04083-0.
Източник: Diet, Gut Microbes, and Immunity, Harvard Medical School



















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
YKoshev
Доколко съвместими са минерално-суровинният отрасъл и чистата околна среда?
Козон
Мистериозен череп на гръцки хоминин е датиран на поне 286 000 години
Peter Petrov
След многократни експлозии нов тест за мегаракетата на Мъск
поп Дръвчо
Гледайте за първи път на живо как новооткритият "междузвезден посетител" 3I/ATLAS се устремява към нас