"Коронавирусната ваксина на Pfizer не предизвиква притеснения за безопасността", пише в доклад на Американската администрация по храните и лекарствата (FDA), публикуван във вторник.
Подробните данни показват, че ваксината на Pfizer е високоефективна и безопасна, на базата на клинично изпитване с повече от 40 000 участници.
Появили са се временни странични ефекти, които обикновено се очакват при повечето ваксини. Честите нежелани реакции са болка на мястото на инжектиране, умора и главоболие.
Експертен комитет, свикан от FDA, ще се срещне в четвъртък, за да обсъди заявлението на Pfizer за спешна употреба, а решението на агенцията се очаква скоро след това.
Във вторник американският регулатор FDA публикува най-подробния преглед към коронавирусната ваксина на Pfizer, очертавайки нейната безопасност и страничните ефекти, наблюдавани в масовото клинично изпитване.
Като цяло констатациите са положителни, като проучването не предполага сериозни притеснения за безопасността на ваксината на Pfizer. Повечето имунизирани доброволци са имали временни странични ефекти малко след ваксинацията, включително умора, главоболие и болка на мястото на инжектиране.
Американската администрация по храните и лекарствата разглежда ваксината срещу COVID-19 за разрешение за спешна употреба, като решението се очаква след броени дни. Експертна група ще се срещне в четвъртък, за да прегледа заявлението на Pfizer и да препоръча решение на регулаторите от FDA.
Pfizer и BioNTech, неговият германски биотехнологичен партньор, са тествали своята ваксина в глобално проучване, при което повече от 40 000 доброволци са разпределени на случаен принцип или да получат две дози от ваксината или две дози плацебо инжекция.
Макар че Pfizer заявява, че разполага с достатъчно данни, за да докаже, че ваксината е около 95% ефективна за предотвратяване на заболяването COVID-19, компанията трябваше да изчака до 20 ноември, за да подаде заявлението си, за да натрупа достатъчно информация за безопасността й. FDA изисква най-малко два месеца последващи данни за повече от половината доброволци, получили втората си доза.
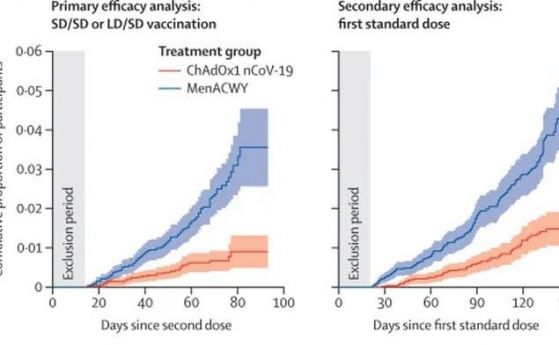
Документите, публикувани във вторник, показват също така, че констатацията за ефективност се запазва, като хората, получили две дози на Pfizer, очевидно са по-добре от групата с плацебо.
Всъщност ваксината на Pfizer изглежда започва да защитава хората около 10 дни след първата доза, въпреки че това е частична степен на защита. Специалистите казват, че втората доза все пак е необходима.
 Криви на кумулативната честота за първата поява на COVID-19 след доза 1. Инфекциите с COVID-19 в плацебо групата са се увеличили по време на проучването, докато хората, които са получили ваксината, обикновено са били добре защитени от инфекция. Кредит: FDA / Pfizer-BioNTech COVID-19 Vaccine VRBPAC Briefing Document
Криви на кумулативната честота за първата поява на COVID-19 след доза 1. Инфекциите с COVID-19 в плацебо групата са се увеличили по време на проучването, докато хората, които са получили ваксината, обикновено са били добре защитени от инфекция. Кредит: FDA / Pfizer-BioNTech COVID-19 Vaccine VRBPAC Briefing Document
Най-честите нежелани реакции са умора и главоболие
Хората на възраст под 55 години съобщават за повече странични ефекти. Тези нежелани реакции са очаквани при ваксина и обикновено се появяват в рамките на няколко дни след приема на дозата и траят средно само ден - два.
В своето обобщение на данните учените от FDA заявяват, че "не са установени конкретни притеснения за безопасността, които да попречат на разпространението й", и да се даде разрешение за спешна употреба.
Честите нежелани реакции, за които хората съобщават след получаване на ваксината на Pfizer, са:
- Болка на мястото на инжектиране (84%)
- Умора (63%)
- Главоболие (55%)
- Мускулна болка (38%)
- Втрисане (32%)
- Болки в ставите (24%)
- Треска (14%)
Тежките странични ефекти
Pfizer и FDA предоставят информация и за съобщени от тестваните доброволци "тежки странични ефекти" - за такива се смятат странични ефекти, които са с такава тежест, че хората не могат да извършват нормални дейности.
Повечето от тежките нежелани реакции са настъпили, след като участниците са получили втората доза, а страничните ефекти са по-чести сред по-младите участници.
Сред хората на възраст от 18 до 55 години 4,6% съобщават за тежка умора след второто инжектиране, а 3,2% имат силно главоболие.
Треската също е често срещана в тази възрастова група. Около 15,8% от доброволците са имали треска от поне 38 градуса по Целзий след втората инжекция.
Сред доброволците на възраст над 55 години 2,8% съобщават за тежка умора, 0,5% изпитват силно главоболие след втората доза, а 10,9% имат температура.
Учени от FDA и от Pfizer и BioNTech преглеждат данните, за да проверят и дали има някакви неочаквани притеснения за безопасността. Окуражаващото е, че не са открили нищо, което да предизвиква безпокойство, заявяват в документа, публикуван във вторник.
Смъртни случаи
В отчетния период от 29 април 2020 г. до 14 ноември 2020 г. са починали общо шест от 43 448 записани участници (0,01%).
Двама от починалите са от групата на ваксинираните, а четирима от плацебо групата. И двамата приели ваксината на Pfizer са били на възраст над 55 години - единият получава сърдечен арест 62 дни след втората доза ваксина и почива 3 дни по-късно, а другият умира от атеросклероза 3 дни след първата доза ваксина. Три от четирите смъртни случая в плацебо групата са настъпили в групата на хората над 55 години, съответно са починали от миокарден инфаркт, хеморагичен инсулт или неизвестни причини.
"Всички смъртни случаи представляват събития, които се случват с характерната за възрастовите групи честота сред общото население", пише в доклада на FDA.
Нефатални сериозни случаи
В общата популация от 43 448, делът на участниците, които са докладвали поне един сериозен случай на заболяване през тестовия период, е 0,6% във ваксиналната група и 0,5% в плацебо групата като разликите в групата на ваксинираните, които са числено по-високи в сравнение с плацебо групата, идват най-често от апендицит (0,04%), остър миокарден инфаркт (0,02%) и мозъчно-съдов инцидент (0,02%). Съобщава се за случаи на апендицит за общо 12 участници и числено по-висок във ваксиналната група - общо 8 участници. Случаите са били считани за несвързани с ваксинацията от изследователите на проучването и според FDA няма ясна основа, на която да се подозира, че този дисбаланс представлява риск, свързан с ваксината.
Три сериозни случая, съобщени в групата на ваксинираните, се разглеждат от изследователите като свързани с ваксината или приложението на ваксината - две наранявания на рамото, камерна аритмия при участник с известни сърдечни заболявания и един случай на лимфаденопатия. По мнение на FDA след прегледа на тези нежелани събития, две от тях са счетени за евентуално свързани с ваксината - болки в рамото, вероятно свързани с прилагането на ваксината или със самата ваксина, и лимфаденопатия (подуване на лимфните възли) на противоположната страна на мястото на инжектиране на ваксината.
Предполагаеми случаи на COVID-19
Както е посочено в протокола, предполагаемите случаи на симптоматичен COVID-19, непотвърдени с PCR, не са регистрирани като нежелани събития, освен ако не отговарят на регулаторните критерии за сериозност. Съобщени са два сериозни случая на предполагаем, но непотвърден COVID-19, и двата във ваксиналната група с треска, неразположение, гадене, главоболие и болки в мускулите. Възможно е, макар и много малко вероятно, това събитие да представлява случай на COVID-19 с множество фалшиво отрицателни тестове, настъпили повече от 7 дни след извършване на ваксинация, и е по-вероятно да представлява несвързан инфекциозен процес.
Сред общо 3 410 случая на предполагаеми, но непотвърдени леки случаи на COVID-19 в общата популация на проучването, 1 594 са възникнали в групата на ваксинираните спрямо 1 816 в групата на плацебо. Предполагаемите случаи на COVID-19, настъпили в рамките на 7 дни след каквато и да е ваксинация, са 409 в групата на ваксината срещу 287 в групата на плацебо. Възможно е дисбалансът при предполагаеми случаи на COVID-19, възникнал в границите на 7 дни след ваксинацията, да представлява реактогенност на ваксината със сходни симптоми.
Парализа на Бел
Регулаторите на FDA отбелязват и странния "числен дисбаланс" при случаите на парализа на Бел, състояние, което временно отслабва мускулите на лицето - четири случая на парализа на Бел сред 20 000 души, които са получили ваксината на Pfizer, в сравнение с нито един случай в групата на плацебо.
Но според FDA честотата на случаите на парализа на Бел сред ваксинираните не е по-висока от това, което би се очаквало средно за населението.
Учените от агенцията заявяват също, че профилът на безопасност на ваксината е „като цяло сходен“ за различните възрасти, пол, етническа принадлежност, расови групи, както и за хора със или без заболявания и хора със или без доказателства за предишна коронавирусна инфекция. Единственото изключение, според тях, е, че по-младите хора са склонни да имат по-чести странични ефекти.
Справка: Vaccines and Related Biological Products Advisory Committee Meeting, December 10, 2020 FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine
Източник: We just got our best look yet at the side effects of Pfizer's coronavirus vaccine. Here's what you should expect if you get the shot., Business Insider
Още по темата
Животът
Резултатите от ваксината на Оксфорд вече са публикувани в научно списание
Животът
Смели твърдения на "Спутник V". Начало на ваксинацията в Русия. Китайската ваксина тръгва по света
Животът
Има ли нещо скандално с освобождаването на Pfizer от дела при проблеми с ваксината














Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон