
В научнопопулярните статии за археология, геология, палеонтология, еволюционна биология и други дисциплини, свързани с реконструкцията на минали събития, винаги се споменава датировка - нещо се е случило преди 10 000 години, 10 милиона или 4 милиарда години. Как се определя това?
В предишната статия "Научни методи за датиране - Дендрохронологията" ви разказахме за един метод, който е подходящ повече за археологически находки като ги определя с точност до година като времевата му скала обхваща малко над 11 000 години за някои райони. Дендрохронологията е методът, който се основава на неравномерното специфично нарастване на ствола на дърветата.
Системата за датиране, с която ще се запознаем сега е методът на радиоактивните изотопи, основан на постоянството на скоростта на разпада им.
Атоми, елементи, химия
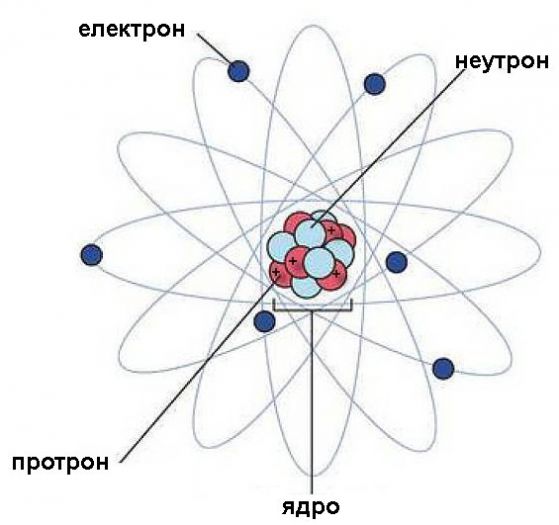 Това е планетарният атомен модел на Нилс Бор, който макар и да е остарял, може да ни послужи за някои базови представи. Ролята на "Слънцето" в този планетарен модел играе ядрото, а електроните се въртят около него като планетите в Слънчевата система. И както в нея електроните са нищожно малки в сравнение с ядрото и пространството, отделящо ги от ядрото.
Това е планетарният атомен модел на Нилс Бор, който макар и да е остарял, може да ни послужи за някои базови представи. Ролята на "Слънцето" в този планетарен модел играе ядрото, а електроните се въртят около него като планетите в Слънчевата система. И както в нея електроните са нищожно малки в сравнение с ядрото и пространството, отделящо ги от ядрото.
В ядрото има два вида частици - протони и неутрони, няричани с общото име нуклони.Те са много по-големи от електрона, а самите те помежду си са почти еднакви по размер.
Химичните елементи са атоми, които имат еднакъв брой протони в ядрата си. Ако ядрото се раздели, елементът няма да бъде същият.
Количеството на протоните е постоянно за всеки конкретен елемент и е равно на броя на електроните. Това число е атомния номер на елемента и в списъка на атомните номера на периодичната система на Менделеев няма никакви пропуски. На всеки номер в нея съответства точно един и само един елемент. Елементът с атомен номер 1 е водородът, 2 - хелий, 3 - литий и т. н до 92 - уран - елементът с най-голям номер (без технеций), който се среща в природата.
Протоните и електроните носят електрически заряд с противоположен знак. Това, че наричаме единият от тях положителен, а другият - отрицателен е произволно взето приемане. Тези заряди са важни, защото химичните връзки на елементите помежду им стават главно чрез взаимодействието на електроните.
Неутроните в атома нямат заряд, но са обвързани здраво с протоните в ядрото, обменяйки си частици и превръщайки се едни в други.
Всички неутрони, протони и електрони във Вселената са абсолютно едни и същи и неразлицими. Не съществува такова нещо като кислороден протон или водороден електрон. Протонът е протон навсякъде, а това, което прави калцият калций, например е не друго, а това, че в него има точно 20 протона и 20 електрона.
Химичните връзки лесно се разкъсват и повторно създават, защото се обменят само електрони в химичните реакции. Химията е танц на електроните.
Силите в атомните ядра са много по-мощни, а разцепването на ядрото или разпада му става не с химически реакции, а с друг вид взаимодействия и радиоактивните часовници са базирани на тях.
Изотопите
Тъй като масата на електроните е пренебрежимо малка, общата маса на атома или неговата "атомна маса" е равна на общия брой протони и неутрони.
Тя обикновено малко повече от два пъти атомния номер, защото в ядрото обикновено са повече неутроните, отколкото протоните. За разлика от броя на протоните, броят на неутроните в атома не е уникална характеристика на елемента.
Атомите на всеки отделен елемент, могат да имат различни "варианти", наречени изотопи с различен брой неутрони, но винаги с еднакъв брой протони.
Някои елементи, като например флуорът, имат само един срещащ се в природата изотоп. Атомния номер на флуора е 9, а неговата атомна маса е 19, от което става ясно, че той има 9 протона и 10 неутрона. Други елементи имат по няколко изотопа. Има общо 5 изотопа на оловото. Те имат един и същ брой протони (и електрони) - 82, което е атомният номер на оловото, но са с различна атомна наса - от 202 до 208.
В природата има три въглеродни изотопа. Въглерод-12 (12С) е изотоп на обикновения въглерод с един и същ брой протони и неутрони - по 6. Има и въглерод-13 с твърде кратък живот за нашите цели, и въглерод-14 (14С), който е рядък, но все пак достатъчно, за да бъде полезен за датирането на органични проби.
Те се разпадат
Не всички изотопи са стабилни. Олово-202 е нестабилен изотоп, а олово-204, -206, -207 и -208 - са стабилни. "Нестабилен" означава, че атомите спонтанно се превръщат в други, с предсказуема скорост, макар и в непредсказуем момент.
Предвидимостта на скоростта на разпада е основата на всички радиометрични часовници.
Има няколко вида радиоактивност, които могат да се използват за датиране - излъчване на частици като електрони, позитрони или алфа частици, спонтанно сливане или улавяне на електрони.
Бета разпадът (β-разпад) е вид радиоактивен разпад, управляван от слабото взаимодействие (вж "Бозоните и фундаменталните взаимодействия").
При този разпад се променя ядреният заряд с единица, но атомната маса остава същата. При това разпадане ядрото излъчва бета частица (електрон или позитрон), а също и частици неутрино - електронно антинеутрино и електронно неутрино.
- бета-минус разпад (β -) - ядрото излъчва електрон и антинеутрино.
При β- разпада, неутронът се превръща в протон. Това означава, че атомната маса остава същата (протоните и неутроните имат една и съща маса), а атомният номер се увеличава с единица, така че атомът се превръща в друг елемент, една клетка надясно в периодичната система. Например, цезий-55 се превръща в барий-56.
- бета-плюс разпад» (β +) - ядрото излъчва позитрон и неутрино.
При β+ разпада, става обратното - протонът се превръща в неутрон, но този път атомният номер намалява с едно и атомът става следващия елемент в периодичната таблица наляво.
- улавяне на електрони (Electron capture) е друга форма на радиоактивно разпадане и има същия ефект. Протонът улавя един от електроните от обвивката на своя атом и се превръща в неутрон (излъчвайки неутрино). Отново, няма промяна в атомното тегло, атомен номер намалява с едно и се превръща в следващия елемент отляво в периодичната таблица.
- алфа разпад - при него с атомът излъчва т.нар алфа частици (хелиеви ядра от два неутрона и два протона). Това означава, че атомната маса намалява с четири и атомният номер намалява с две. Атомът се превръща в елемент, който е вляво на две клетки в периодичната таблица. Един пример на алфа-разпад е превръщането на радиоактивният изотоп уран-238 (92 протона и 146 неутрона) в торий-234 (90 протона и 144 неутрона).
Полуразпад
Всеки нестабилен изотоп се разпада с точно известна скорост, характерна за този изотоп, като разпадът е експоненциален. Една обща мярка за степента на разпад е "период на полуразпад". Това е времето, необходимо половината от останалите атоми на изходния радиоактивен елемент да се разпаднат. Например, останалия изходен радиоактивен материал ще намалее с 1/2 за времето на всеки период на полуразпад (1 → 1/2 → 1/4 → 1/8 → 1/16, и т.н.).. Периодът на полуразпад е един и същ и не зависи от това колко атоми се разпадат. Измерванията на полуразпада днес са много точни, дори и за изключително бавен полуразпад.
| Изходен изотоп | Производен изотоп | Период на полуразпад |
|---|---|---|
| Полоний-218 | Олово-214 | 3 минути |
| Торий-234 | Протактиний-234 | 24 дни |
| Въглерод-14 | Азот-14 | 5,730 години |
| Калий-40 | Аргон-40 | 1.25 млрд години |
| Уран-238 | Олово-206 | 4.47 млрд години |
| Рубидий-87 | Стронций-87 | 48.8 млрд години |
Колкото е по-голям периодът на полуразпад на даден изотоп, толкова по-древни геоложки събития могат да се датират с него.
Например, периодът на полуразпад (Т½) на въглерод-14 е 5730 ± 40 години. Днес пределната възраст на пробата, на която може да бъде точно определена по радиовъглеродния метод е около 60 000 години, което е около 10 периоди на полуразпад на 14С. През това време съдържанието на 14С намалява приблизително 1000 пъти (около 1разпад на час на грам въглерод) и ще трябва да използваме по-бавен часовник.
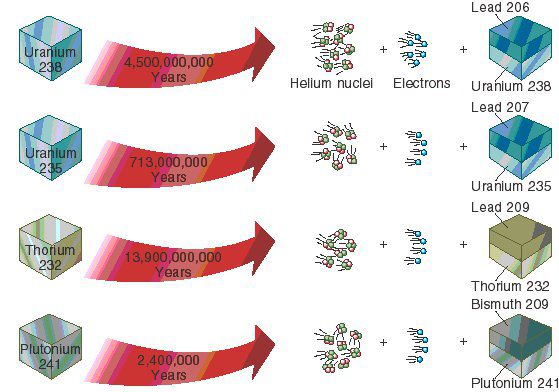
Как работи радиоизотопният метод
Радиоизотопното датиране обикновено използва за данни вулканични скали. Това са скали, които образуват, когато горещият, разтопен материал се охлажда и втвърдява. Вулканични скали са например гранитът и базалтът.
Докато веществото е в течно състояние, например като течно магма, неговия химичен състав е променлив - отделните му компоненти се смесват, някои се изпаряват и т.н. Но когато минералът се втвърди, започва да се държи като относително затворена система. Това означава, че радиоактивните изотопи, присъстващи в него остават заключени и намаляването на техния брой се проявява само заради разпада, който става с постоянна скорост. Всички продукти на разпада в идеалния случай също остават в рамките на минерала. Става "нулиране на часовника".
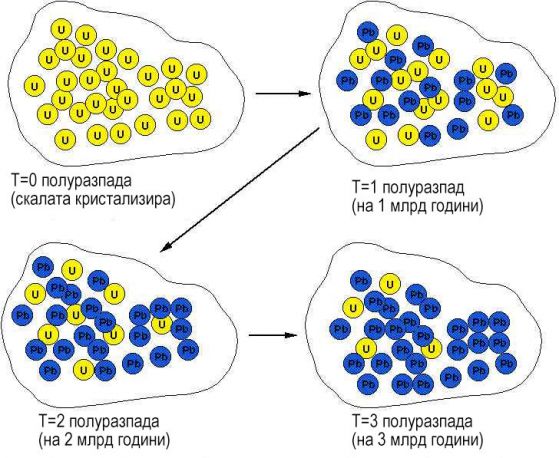
За съжаление, такива идеални случаи са малко в природата.
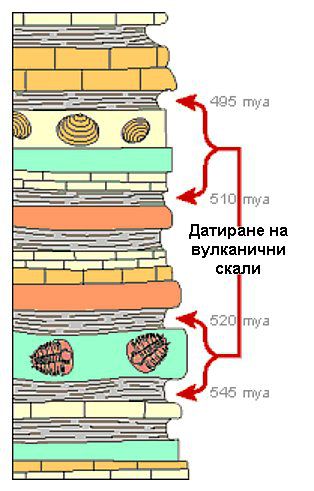 Фосилите обикновено се откриват в седиментни, а не в вулканични скали. Седиментните скали могат да бъдат датирани с помощта на радиоактивен въглерод, но тъй като въглеродът се разпада сравнително бързо, това работи само за млади скали от около 50 хиляди години.
Фосилите обикновено се откриват в седиментни, а не в вулканични скали. Седиментните скали могат да бъдат датирани с помощта на радиоактивен въглерод, но тъй като въглеродът се разпада сравнително бързо, това работи само за млади скали от около 50 хиляди години.
Така че, за да се датират по-стари вкаменелости, учените търсят слоеве от вулканични скали или вулканична пепел над и под фосилите. Изследователите датират вулканичните скали, използвайки елементи, които имат по-бавен разпад като уран и калий. Чрез датиране на тези околни слоеве, те могат да разберат колко най-млади и най-стари могат да са фосилите.
Калий-аргонов метод
Калий-40 има период на полуразпад от 1.26 млрд. години и се използва често за датиране в еволюционен мащаб. Този "часовник" се нарича калиево- аргонен, защото аргон-40 (една клетка наляво в периодичната система) е един от елементите, в които се разлага калий-40.
Въглероден метод
За да се определи абсолютната възраст на по-млади отложения (не повече от 100 хиляди години), особено при запазени органични материали, широко се използва радиовъглеродния метод.
Голяма част от въглерода в атмосферния въглероден диоксид е въглерод-12, който не е радиоактивен. Радиоактивният изотоп на въглерода 14C се образува в горните слоеве на атмосферата в резултат на бомбардировка на ядрата на азота с неутроните на космическите лъчи:
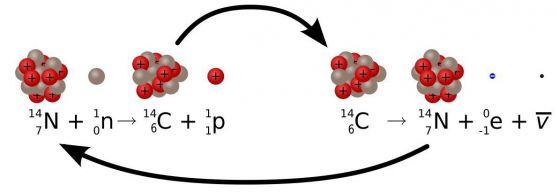 Космическите частици лъчи обстрелват протон в ядрото на атом азот и го превръшат в неутрон. Когато това се случи, атомът се превръща в въглерод-14, който се намира на една клетка вляво от азота в периодичната система. Скоростта на това превръщане е приблизително постоянна и зависи от колебанията на слънчевата активност и така работи радиовъглеродното датиране.
Космическите частици лъчи обстрелват протон в ядрото на атом азот и го превръшат в неутрон. Когато това се случи, атомът се превръща в въглерод-14, който се намира на една клетка вляво от азота в периодичната система. Скоростта на това превръщане е приблизително постоянна и зависи от колебанията на слънчевата активност и така работи радиовъглеродното датиране.
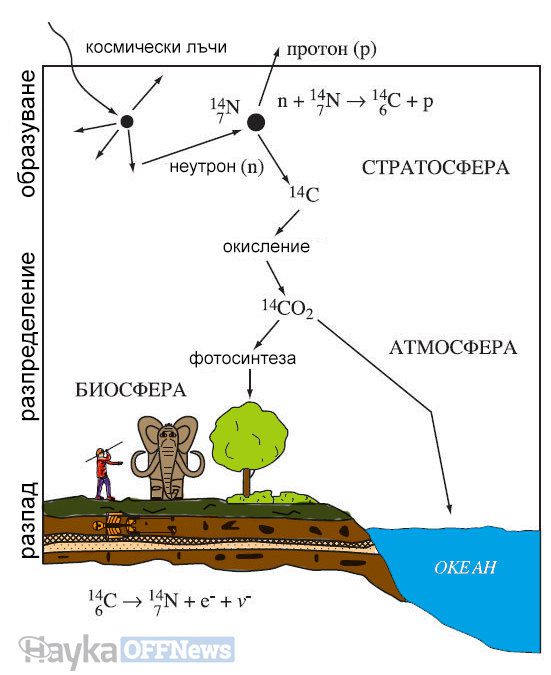
Около един атом на трилион е радиоактивен въглерод-14. Той се разпада, с период на полуразпад 5730 години, както вече бе споменато, в азот-14. За биохимията на растенията няма разлика между тези два изотопа. Така растенията включват и двата вида въглеродни атоми във фотосинтезата за производство на захар в същите пропорции, в които се срещат в атмосферата (1: 10–12). Въглеродът, влизащ в състава на атмосферата (заедно с процента атоми 14C) бързо в сравнение с неговия полуразпад се разпространява чрез хранителната верига, когато растенията биват изядени от тревопасните, тревопасните от хищниците и т. н. Всички живи същества, независимо дали са растения или животни, имат приблизително равно съотношение 14С / 12С, което е в същото съотношение като в атмосферата.
След смъртта на организма притокът на въглерод в него спира, системата става условно затворена, както в случая на втвърдения минерал, и започва снижаване на съотношението 14C/12C за сметка на разпада на радиоактивния изотоп 14C.
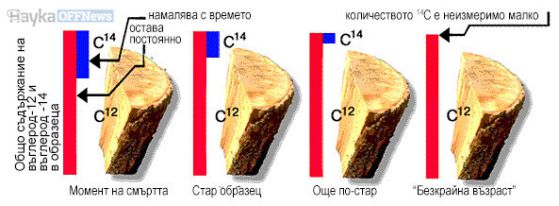
За щастие имаме точни данни за колебанията на 14С в атмосферата и може да се въвеждат корекции, които да повишат точността на изчисленията.
Да не забравяме, че за приблизително същия период от време, обхванат от въглеродното датиране, има алтернативен метод за датиране по дървесните пръстени - дендрохронологията, метод, точен до година. Така по определената с радиовъглеродно датиране възраст на дървесни проби, чиято възраст независимо е определена с помощта на дървесните пръстени, може да се калибрират грешките в датирането по въглерода.
Проблеми
Обикновено е много трудно да се прецени началното съдържание в скалата на продуктите на разпада на даден изотоп. Например, калий-аргоновият метод се основава на изключително благоприятното обстоятелство, че от разтопените скали аргон обикновено се изпарява. Но по време на кристализацията на минерала може да се случи да се улови аргон отвън. Как да се разграничи този аргон от аргона, който се е образувал по-късно от разпада на изотопа 40К? Възможно е да се предположи, че уловеният аргон има същото съотношение на изотопите 40Ar / 36Ar, както в съвременната атмосфера. Чрез измерване на количеството на 36Ar, тогава може да се изчисли количеството на "чистия" радиогенен аргон 40Ar. Но това допускане не винаги е оправдано.
Всеки от радиометричните методи има своите предимства и недостатъци. Например, недостатъкът на ураново-оловното датиране е това, че минералите с високо съдържание на уран се срещат рядко. Недостатъкът на калий-аргоновия е висока степен на вероятност за изтичане на образувания аргон във вече втвърдения минерал. Използването на радиовъглеродния метод също се сблъсква с трудности - погребаният органичен въглерод може да се замърси от страничен въглерод - както "древен" (с малък процент 14С), така и "млад".
Всеки един от радиометричните методи може да даде погрешно датиране. Ето защо, учените се опитват да извършват датирането на един и същ слой с помощта на няколко независими методи. Ако резултатите са повече или по-малко съвпадат, това е добре, но ако не е така, започва търсене на възможни източници на грешки.
Да сверим часовниците
Неточността на повечето методи за абсолютна геохронология не дава основание да се отрече достоверността на датирането в археологията, палеонтологията и еволюционната биология. Основното предимство на тези методи е, че са много. И възрастта на изследователските обекти днес обикновено се определя от няколко независими методи. В повечето случаи те дават сходни резултати, които също съответстват с тези, които дава относителната геохронология - според подреждането на геоложките пластове.
Източници:
Radiometric Dating, evolution.berkeley.edu
Radiometric Dating, tech-faq.com
Хронология далекого прошлого, Александр Марков
ROMANCING THE ISOTOPES: RADIOMETRIC DATING


















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
1
08.04 2016 в 00:57
Последни коментари
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон
dolivo
Сахара очаква 75% увеличение на валежите до 2100 г.
dolivo
Земната ябълка: стара култура за новите климатични времена