

–ù–∞ 6 –º–∞—Ä—Ç 2019 –≥. —â–µ —Å–µ –Ω–∞–≤—ä—Ä—à–∞—Ç 150 –≥–æ–¥–∏–Ω–∏ –æ—Ç —Ñ–æ—Ä–º—É–ª–∏—Ä–∞–Ω–µ—Ç–æ –Ω–∞ –ü–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ –Ω–∞ —Ö–∏–º–∏—á–µ—Å–∫–∏—Ç–µ –µ–ª–µ–º–µ–Ω—Ç–∏ –æ—Ç –î–º–∏—Ç—Ä–∏–π –ú–µ–Ω–¥–µ–ª–µ–µ–≤.
–ù–æ –∏ –¥–æ—Å–µ–≥–∞ —Ö–∏–º–∏—Ü–∏—Ç–µ –Ω–µ –º–æ–≥–∞—Ç –¥–∞ —Å–µ —Å–ø–æ—Ä–∞–∑—É–º–µ—è—Ç –∫–æ–π –µ –Ω–∞–π-–¥–æ–±—Ä–∏—è—Ç –Ω–∞—á–∏–Ω –∑–∞ –ø–æ–¥—Ä–µ–∂–¥–∞–Ω–µ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –∏ –¥–∞–≤–∞—Ç –≤—Å—è–∫–∞–∫–≤–∏ –ø—Ä–µ–¥–ª–æ–∂–µ–Ω–∏—è¬Ý- –æ—Ç —Å–ø–∏—Ä–∞–ª–æ–æ–±—Ä–∞–∑–Ω–∏ –∞–ª—Ç–µ—Ä–Ω–∞—Ç–∏–≤–∏ –¥–æ —Ä–∞–¥–∏–∫–∞–ª–Ω–æ —É–¥—ä–ª–∂–µ–Ω–∏ –≤–µ—Ä—Å–∏–∏. –ó–∞ –Ω—è–∫–æ–∏ –æ—Ç —Ç—è—֬ݗĖ∞–∑–∫–∞–∑–≤–∞ –î–∂–æ—à—É–∞ –•–∞—É–≥–∏–≥–æ (Joshua Howgego) –≤¬ÝNew Scientist
–ü–ª—ä–∑–Ω–µ—Ç–µ –ø—Ä—ä—Å—Ç–∏—Ç–µ —Å–∏ –≤—ä—Ä—Ö—É –±–µ–ª–∏—Ç–µ –∫–ª–∞–≤–∏—à–∏ –Ω–∞ –ø–∏–∞–Ω–æ. –ù–æ—Ç–∏—Ç–µ —Å—Ç–∞–≤–∞—Ç —Å –≤—Å–µ –ø–æ-–≥–æ–ª—è–º–∞ –≤–∏—Å–æ—á–∏–Ω–∞, –¥–æ–∫–∞—Ç–æ —Ä—ä–∫–∞—Ç–∞ –≤–∏ —Å–µ –¥–≤–∏–∂–∏ –Ω–∞–¥—è—Å–Ω–æ. –ù–∞ –æ—Å–º–∏—è –∫–ª–∞–≤–∏—à —Å–µ —Å–ª—É—á–≤–∞ –Ω–µ—â–æ –∫—Ä–∞—Å–∏–≤–æ:¬Ý—á—É–≤–∞ —Å–µ –Ω–æ—Ç–∞, –≤ –∫–æ—è—Ç–æ –∏–º–∞ –Ω–µ—â–æ –æ—Ç –ø—ä—Ä–≤–∞—Ç–∞, —Å–∞–º–æ —á–µ —Ŭݖ¥—Ä—É–≥–∞ –≤–∏—Å–æ—á–∏–Ω–∞.
–ù–µ—â–æ –ø–æ–¥–æ–±–Ω–æ —Å–µ —Å–ª—É—á–≤–∞ —Å —Ö–∏–º–∏—á–µ—Å–∫–∏—Ç–µ –µ–ª–µ–º–µ–Ω—Ç–∏ –ø—Ä–µ–¥–∏ –ø–æ–≤–µ—á–µ –æ—Ç 150 –≥–æ–¥–∏–Ω–∏. –£—á–µ–Ω–∏—Ç–µ –¥–æ—Ä–∏ –≥–æ –Ω–∞—Ä–∏—á–∞—Ç ‚Äã‚Äã–∑–∞–∫–æ–Ω –Ω–∞ –æ–∫—Ç–∞–≤–∏—Ç–µ. –ò–º–µ–Ω–Ω–æ —Ç–æ–≤–∞ –ø–æ–≤—Ç–æ—Ä–µ–Ω–∏–µ –≤ —Å–≤–æ–π—Å—Ç–≤–∞—Ç–∞ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ¬Ý–ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ —É–ª–∞–≤—è —Ç–æ–ª–∫–æ–≤–∞ –∫—Ä–∞—Å–∏–≤–æ. –ü–æ–¥–æ–±–Ω–∏—Ç–µ –µ–ª–µ–º–µ–Ω—Ç–∏ —Å–µ –æ—Ñ–æ—Ä–º—è—Ç –≤ –∫–æ–ª–æ–Ω–∏ –∏–ª–∏ –≥—Ä—É–ø–∏. –ò–º–∞ –≥—Ä—É–ø–∞, —Å—ä—Å—Ç–æ—è—â–∞ —Å–µ –æ—Ç –±–ª–∞–≥–æ—Ä–æ–¥–Ω–∏ –≥–∞–∑–æ–≤–µ –∫–∞—Ç–æ –∞—Ä–≥–æ–Ω –∏ –Ω–µ–æ–Ω, –∫–æ–∏—Ç–æ –ø–æ—á—Ç–∏ –Ω–µ —Ä–µ–∞–≥–∏—Ä–∞—Ç —Å –Ω–∏—â–æ, –¥—Ä—É–≥–∏ —Å—ä–¥—ä—Ä–∂–∞—Ç —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏ –º–µ—Ç–∞–ª–∏, –Ω—è–∫–æ–∏ –æ—Ç –∫–æ–∏—Ç–æ, –∫–∞—Ç–æ —Ñ—Ä–∞–Ω—Ü–∏–π, –µ–∫—Å–ø–ª–æ–¥–∏—Ä–∞—Ç –ø—Ä–∏ –∫–æ–Ω—Ç–∞–∫—Ç —Å –≤–æ–¥–∞.
–ù–æ –∏–º–∞ —Å—ä–º–Ω–µ–Ω–∏—è –¥–∞–ª–∏ –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ –µ –Ω–∞–π-–¥–æ–±—Ä–∞—Ç–∞ –≤—ä–∑–º–æ–∂–Ω–∞ –∫–æ–Ω—Ñ–∏–≥—É—Ä–∞—Ü–∏—è. –¢–æ—á–Ω–æ –∫–∞–∫—Ç–æ –Ω–æ—Ç–∏—Ç–µ –º–æ–≥–∞—Ç –¥–∞ –±—ä–¥–∞—Ç –ø–æ–¥—Ä–µ–¥–µ–Ω–∏ –ø–æ —Ä–∞–∑–ª–∏—á–Ω–∏ –Ω–∞—á–∏–Ω–∏, –∑–∞ –¥–∞ –∑–∞–ø–∏—à–∞—Ç –º—É–∑–∏–∫–∞, —Ç–∞–∫–∞ –∏ —Å—ä—â–Ω–æ—Å—Ç—Ç–∞ –Ω–∞ –≤–∑–∞–∏–º–æ–æ—Ç–Ω–æ—à–µ–Ω–∏—è—Ç–∞ –º–µ–∂–¥—É –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –º–æ–∂–µ –¥–∞ –±—ä–¥–µ –∏–∑–æ–±—Ä–∞–∑–µ–Ω–∞ –ø–æ —Ä–∞–∑–ª–∏—á–µ–Ω –Ω–∞—á–∏–Ω. –ù—è–º–∞ –ª–µ—Å–µ–Ω –Ω–∞—á–∏–Ω –¥–∞ —Å–µ –ø—Ä–µ—Ü–µ–Ω–∏ –∫–æ–π –µ –ø–æ-–¥–æ–±—ä—Ä –∏–ª–∏ –ø–æ-–∏—Å—Ç–∏–Ω—Å–∫–∏. –¢–∞–∫–∞ —á–µ —Å–µ –≤–æ–¥—è—Ç —Å–ø–æ—Ä–æ–≤–µ –ø–æ –ø–æ–≤–æ–¥ –≤–∏–¥–∏–º–∏ –Ω–µ–¥–æ—Å—Ç–∞—Ç—ä—Ü–∏ –≤ —Å–µ–≥–∞—à–Ω–∞—Ç–∞ –¥–æ–≥–æ–≤–æ—Ä–µ–Ω–æ—Å—Ç, –∞ –∏–º–∞ —Ö–∏–º–∏—Ü–∏, –∫–æ–∏—Ç–æ —Ç–≤—ä—Ä–¥—è—Ç, —á–µ –Ω—è–∫–æ–∏ –µ–ª–µ–º–µ–Ω—Ç–∏ —Ç—Ä—è–±–≤–∞ –¥–∞ –±—ä–¥–∞—Ç –ø—Ä–µ–º–µ—Å—Ç–µ–Ω–∏ - –∞ –¥—Ä—É–≥–∏ —Ä–∞–±–æ—Ç—è—Ç –ø–æ –ø–æ-—Ä–∞–¥–∏–∫–∞–ª–Ω–∏ –Ω–∞—á–∏–Ω–∏ –∑–∞ –ø—Ä–µ–Ω–∞—Ä–µ–∂–¥–∞–Ω–µ –Ω–∞ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞.
–ü—ä—Ä–≤–æ–Ω–∞—á–∞–ª–Ω–æ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –±—è—Ö–∞ –æ—Ä–≥–∞–Ω–∏–∑–∏—Ä–∞–Ω–∏ –ø–æ –∞—Ç–æ–º–Ω–æ —Ç–µ–≥–ª–æ. –°–µ–≥–∞ –≥–∏ –ø–æ–¥—Ä–µ–∂–¥–∞–º–µ –ø–æ –±—Ä–æ—è –Ω–∞ –ø—Ä–æ—Ç–æ–Ω–∏—Ç–µ –≤ —Ç—è—Ö–Ω–æ—Ç–æ —è–¥—Ä–æ. –ù–∏–µ –∑–Ω–∞–µ–º —Å—ä—â–æ, —á–µ —Ç–µ—Ö–Ω–∏—Ç–µ —Å–≤–æ–π—Å—Ç–≤–∞ –¥–æ –≥–æ–ª—è–º–∞ —Å—Ç–µ–ø–µ–Ω —Å–µ –æ–ø—Ä–µ–¥–µ–ª—è—Ç –æ—Ç –ø–æ–¥—Ä–µ–∂–¥–∞–Ω–µ—Ç–æ –Ω–∞ –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª–Ω–æ –∑–∞—Ä–µ–¥–µ–Ω–∏—Ç–µ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏, –∫–æ–∏—Ç–æ –æ–±–∏–∫–∞–ª—è—Ç –≤ –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª–Ω–∏ –æ–±–≤–∏–≤–∫–∏ –æ–∫–æ–ª–æ —è–¥—Ä–æ—Ç–æ.
–ù–∞–π-–ª–µ–∫–∏—Ç–µ –µ–ª–µ–º–µ–Ω—Ç–∏ –∏–º–∞—Ç —Å–∞–º–æ –µ–¥–Ω–∞ –æ–±–≤–∏–≤–∫–∞, –∫–æ—è—Ç–æ –º–æ–∂–µ –¥–∞ –ø–æ–±–µ—Ä–µ –¥–≤–µ –æ—Ç —Ç–µ–∑–∏ —á–∞—Å—Ç–∏—Ü–∏. –ü–æ-—Ç–µ–∂–∫–∏—Ç–µ –µ–ª–µ–º–µ–Ω—Ç–∏ –∏–º–∞—Ç –ø–æ–≤–µ—á–µ –æ–±–≤–∏–≤–∫–∏, –∫–æ–∏—Ç–æ –º–æ–≥–∞—Ç –¥–∞ –∑–∞–¥—ä—Ä–∂–∞—Ç –ø–æ-–≥–æ–ª—è–º –±—Ä–æ–π –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏. –¢–æ–≤–∞, –∫–æ–µ—Ç–æ –Ω–∞–∏—Å—Ç–∏–Ω–∞ –∏–º–∞ –∑–Ω–∞—á–µ–Ω–∏–µ –∑–∞ –ø–æ–≤–µ–¥–µ–Ω–∏–µ—Ç–æ –Ω–∞ –≤—Å–µ–∫–∏ –µ–ª–µ–º–µ–Ω—Ç, –µ –∫–æ–ª–∫–æ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞ –∏–º–∞ –≤ –Ω–µ–≥–æ–≤–∞—Ç–∞ –≤—ä–Ω—à–Ω–∞ –æ–±–≤–∏–≤–∫–∞.
–¢–æ–∑–∏ –±—Ä–æ–π –æ–±–∏–∫–Ω–æ–≤–µ–Ω–æ —Å–µ –≤–ø–∏—Å–≤–∞ –¥–æ–±—Ä–µ –≤ –Ω–∞—á–∏–Ω–∞, –ø–æ –∫–æ–π—Ç–æ –µ –ø–æ–¥—Ä–µ–¥–µ–Ω–∞ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞, –∞ –∏–º–µ–Ω–Ω–æ –∑–∞ –ø–æ—Å—Ç–∞–≤—è–Ω–µ—Ç–æ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∏ —Å—ä—Å —Å—Ö–æ–¥–Ω–∏ —Å–≤–æ–π—Å—Ç–≤–∞ –≤ –µ–¥–Ω–∞ –∏ —Å—ä—â–∞ –≥—Ä—É–ø–∞. –ù–∞–ø—Ä–∏–º–µ—Ä, –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –æ—Ç –≥—Ä—É–ø–∞ 1 –∏–º–∞—Ç –µ–¥–∏–Ω –µ–ª–µ–∫—Ç—Ä–æ–Ω –≤ —Å–≤–æ—è—Ç–∞ –≤—ä–Ω—à–Ω–∞ –æ–±–≤–∏–≤–∫–∞, –∞ —Ç–µ–∑–∏ –≤ –≥—Ä—É–ø–∞ 2 –∏–º–∞—Ç –¥–≤–µ. –ù–æ —Ç–æ–≤–∞ –Ω–µ –≤–∏–Ω–∞–≥–∏ —Å—ä–≤–ø–∞–¥–∞ —Ç–æ–ª–∫–æ–≤–∞ –¥–æ–±—Ä–µ.
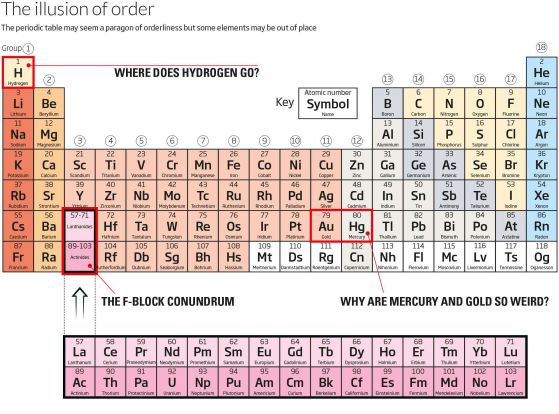
–ö—ä–¥–µ –æ—Ç–∏–≤–∞ –≤–æ–¥–æ—Ä–æ–¥—ä—Ç?
–í–∑–µ–º–µ—Ç–µ –ø—ä—Ä–≤–∏—è –µ–ª–µ–º–µ–Ω—Ç. –í–æ–¥–æ—Ä–æ–¥—ä—Ç –∏–º–∞ –µ–¥–∏–Ω –µ–ª–µ–∫—Ç—Ä–æ–Ω –≤ –Ω–∞–π-–≤—ä–Ω—à–Ω–∞—Ç–∞ —Å–∏ –æ–±–≤–∏–≤–∫–∞, —Ç–∞–∫–∞ —á–µ –º–æ–∂–µ –¥–∞ —Å–µ –ø—Ä–µ–¥–ø–æ–ª–æ–∂–∏, —á–µ —Ç—Ä—è–±–≤–∞ –¥–∞ –µ —Ç–æ—á–Ω–æ —Ç–∞–º, –∫—ä–¥–µ—Ç–æ –µ, –≤ –≥—Ä—É–ø–∞ 1 –Ω–∞–¥ –ª–∏—Ç–∏—è –∏ –Ω–∞—Ç—Ä–∏—è, –∫–æ–∏—Ç–æ —Å—ä—â–æ –∏–º–∞—Ç –µ–¥–∏–Ω –µ–ª–µ–∫—Ç—Ä–æ–Ω –≤ –Ω–∞–π-–≤—ä–Ω—à–Ω–∞—Ç–∞ —Å–∏ –æ–±–≤–∏–≤–∫–∞. –ò –≤—Å–µ –ø–∞–∫ –≤–æ–¥–æ—Ä–æ–¥—ä—Ç –µ –≥–∞–∑, –∞ –Ω–µ –º–µ—Ç–∞–ª, —Ç–∞–∫–∞ —á–µ –Ω–µ–≥–æ–≤–∏—Ç–µ —Å–≤–æ–π—Å—Ç–≤–∞ –Ω–µ —Å–∞ –ø–æ–¥—Ö–æ–¥—è—â–∏ –∑–∞ —Ç–∞–∑–∏ –≥—Ä—É–ø–∞.
–ó–∞—Ç—Ä—É–¥–Ω–µ–Ω–∏–µ—Ç–æ –≤—ä–∑–Ω–∏–∫–≤–∞, –∑–∞—â–æ—Ç–æ –≤—ä–≤ –≤—ä–Ω—à–Ω–∞—Ç–∞ –æ–±–≤–∏–≤–∫–∞, –∫–æ—è—Ç–æ –º–æ–∂–µ –¥–∞ —Å—ä–¥—ä—Ä–∂–∞ —Å–∞–º–æ –¥–≤–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞, –≤–æ–¥–æ—Ä–æ–¥—ä—Ç –∏–º–∞ –µ–¥–∏–Ω –µ–ª–µ–∫—Ç—Ä–æ–Ω, –Ω–æ –ø—ä–∫ –Ω–µ –º—É –¥–æ—Å—Ç–∏–≥–∞ —Å—ä—â–æ –µ–¥–∏–Ω, –∑–∞ –¥–∞ –∏–º–∞ –ø—ä–ª–Ω–∞ –æ–±–≤–∏–≤–∫–∞.
–ö–∞—Ç–æ —Å–µ –∏–º–∞ –ø—Ä–µ–¥–≤–∏–¥, —á–µ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ —Å–µ —Å—Ç—Ä–µ–º—è—Ç –¥–∞ –∑–∞–ø—ä–ª–Ω—è—Ç –≤—ä–Ω—à–Ω–∏—Ç–µ —Å–∏ –æ–±–≤–∏–≤–∫–∏, —Ç–æ–≤–∞ –≥–æ –ø—Ä–∞–≤–∏ –º–Ω–æ–≥–æ —Ä–µ–∞–∫—Ç–∏–≤–µ–Ω. –í —Ç–æ–∑–∏ —Å–º–∏—Å—ä–ª –≤–æ–¥–æ—Ä–æ–¥—ä—Ç –ø—Ä–∏–ª–∏—á–∞ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –≤ –≥—Ä—É–ø–∞ 17, –∞ –∏–º–µ–Ω–Ω–æ —Ö–∞–ª–æ–≥–µ–Ω–∏—Ç–µ –∫–∞—Ç–æ —Ö–ª–æ—Ä. –¢–µ—Ö–Ω–∏—Ç–µ –≤—ä–Ω—à–Ω–∏ –æ–±–≤–∏–≤–∫–∏ —Ç—Ä—è–±–≤–∞ –¥–∞ —É–ª–æ–≤—è—Ç —Å–∞–º–æ –µ–¥–∏–Ω –µ–ª–µ–∫—Ç—Ä–æ–Ω –∑–∞ –ø–æ—Å—Ç–∏–≥–∞–Ω–µ –Ω–∞ –ø—ä–ª–Ω–∞ –æ–±–≤–∏–≤–∫–∞ –æ—Ç –æ—Å–µ–º, –∫–æ–µ—Ç–æ –≥–∏ –ø—Ä–∞–≤–∏ —Å—Ö–æ–¥–Ω–æ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏. –ü–æ –æ—Ç–Ω–æ—à–µ–Ω–∏–µ –Ω–∞ —Å–≤–æ–π—Å—Ç–≤–∞—Ç–∞ —Å–∏ –≤–æ–¥–æ—Ä–æ–¥—ä—Ç –µ –ø–æ-–±–ª–∏–∑–æ –¥–æ —Ö–ª–æ—Ä–∞, –æ—Ç–∫–æ–ª–∫–æ—Ç–æ –¥–æ –ª–∏—Ç–∏—è.
–ó–∞—â–æ –∂–∏–≤–∞–∫—ä—Ç –∏ –∑–ª–∞—Ç–æ—Ç–æ —Å–∞ —Ç–æ–ª–∫–æ–≤–∞ —Å—Ç—Ä–∞–Ω–Ω–∏?
–ù–∞–¥–æ–ª—É –ø–æ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞ –Ω—è–º–∞ —Å–≤–æ–±–æ–¥–Ω–∏ –º–µ—Å—Ç–∞ –∑–∞ –Ω–µ–ø—Ä–∞–≤–∏–ª–Ω–æ –ø–æ—Å—Ç–∞–≤–µ–Ω–∏ –µ–ª–µ–º–µ–Ω—Ç–∏.
–î–æ—Ä–∏ –∏ —Ç–∞–∫–∞, –Ω—è–∫–æ–ª–∫–æ –æ—Ç —Ç–∏—Ç—É–ª—è—Ä–∏—Ç–µ –∏–∑–≥–ª–µ–∂–¥–∞—Ç –∫–∞—Ç–æ —á—É–∂–¥–∏. –ù–∞–ø—Ä–∏–º–µ—Ä –∂–∏–≤–∞–∫—ä—Ç, –∫–æ–π—Ç–æ –µ —Ç–µ—á–µ–Ω –ø—Ä–∏ —Å—Ç–∞–π–Ω–∞ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞. –í —Ç–æ–∑–∏ —Å–º–∏—Å—ä–ª –µ —Å—ä–≤—Å–µ–º —Ä–∞–∑–ª–∏—á–µ–Ω –æ—Ç –æ—Å—Ç–∞–Ω–∞–ª–∏—Ç–µ —á–ª–µ–Ω–æ–≤–µ –Ω–∞ –≥—Ä—É–ø–∞ 12, —Å—Ä–µ–¥ –∫–æ–∏—Ç–æ —Å–∞ —Ü–∏–Ω–∫ –∏ –∫–∞–¥–º–∏–π, –∫–æ–∏—Ç–æ —Å–∞ —Ç–≤—ä—Ä–¥–∏ –º–µ—Ç–∞–ª–∏. –ö–∞–∫–≤–æ —Å–µ —Å–ª—É—á–≤–∞?
–ö–æ–ª–∫–æ—Ç–æ –ø–æ-–Ω–∞–¥–æ–ª—É –æ—Ç–∏–≤–∞–º–µ, —Ç–æ–ª–∫–æ–≤–∞ –ø–æ–≤–µ—á–µ –æ—Ç –ø–æ–ª–æ–∂–∏—Ç–µ–ª–Ω–æ –∑–∞—Ä–µ–¥–µ–Ω–∏—Ç–µ –ø—Ä–æ—Ç–æ–Ω–∏ —Å—ä–¥—ä—Ä–∂–∞ —è–¥—Ä–æ—Ç–æ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∞. –ó–∞—Ä–∞–¥–∏ —Ç–æ–≤–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ —Å–µ –¥–≤–∏–∂–∞—Ç –≤—Å–µ –ø–æ-–±—ä—Ä–∑–æ –∏ –ø–æ-–±—ä—Ä–∑–æ. –ö–æ–≥–∞—Ç–æ —Å—Ç–∏–≥–Ω–µ–º –¥–æ –∂–∏–≤–∞–∫–∞, –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ —Å–µ –≤—ä—Ä—Ç—è—Ç —Å 58% –æ—Ç —Å–∫–æ—Ä–æ—Å—Ç—Ç–∞ –Ω–∞ —Å–≤–µ—Ç–ª–∏–Ω–∞—Ç–∞. –°–ø–æ—Ä–µ–¥ –°–ø–µ—Ü–∏–∞–ª–Ω–∞—Ç–∞ —Ç–µ–æ—Ä–∏—è –Ω–∞ –æ—Ç–Ω–æ—Å–∏—Ç–µ–ª–Ω–æ—Å—Ç—Ç–∞ –Ω–∞ –ê–π–Ω—â–∞–π–Ω, —Ç–æ–≤–∞ –æ–∑–Ω–∞—á–∞–≤–∞, —á–µ —Ç—è—Ö–Ω–∞—Ç–∞ –µ—Ñ–µ–∫—Ç–∏–≤–Ω–∞ –º–∞—Å–∞ –µ –∑–Ω–∞—á–∏—Ç–µ–ª–Ω–æ –ø–æ-–≤–∏—Å–æ–∫–∞ –æ—Ç –Ω–æ—Ä–º–∞–ª–Ω–∞—Ç–∞ –º–∞—Å–∞ –Ω–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞, –∫–æ–µ—Ç–æ —É–≤–µ–ª–∏—á–∞–≤–∞ –≤—ä—Ç—Ä–µ—à–Ω–æ—Ç–æ –ø—Ä–∏—Ç–µ–≥–ª—è–Ω–µ, –∫–æ–µ—Ç–æ –∏–∑–ø–∏—Ç–≤–∞—Ç.
–Ý–µ–∑—É–ª—Ç–∞—Ç—ä—Ç –µ, —á–µ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ –Ω–∞ –∂–∏–≤–∞–∫–∞ —Å–µ –≤—ä—Ä—Ç—è—Ç —Ç–æ–ª–∫–æ–≤–∞ —Å–∏–ª–Ω–æ, —á–µ –Ω–µ –º–æ–≥–∞—Ç –¥–∞ —Å–µ —Å–ø–æ–¥–µ–ª—è—Ç, –∑–∞ –¥–∞ –æ–±—Ä–∞–∑—É–≤–∞—Ç –≤—Ä—ä–∑–∫–∏ —Å –¥—Ä—É–≥–∏ –∞—Ç–æ–º–∏, –∫–æ–µ—Ç–æ –µ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ, –∑–∞ –¥–∞ —Å–µ –ø–æ–ª—É—á–∏ —Ç–≤—ä—Ä–¥–æ –≤–µ—â–µ—Å—Ç–≤–æ. –°—ä—â–æ—Ç–æ –æ–±—è—Å–Ω—è–≤–∞ –∑–∞—â–æ –∑–ª–∞—Ç–æ—Ç–æ –µ —Å —É–Ω–∏–∫–∞–ª–µ–Ω —Ü–≤—è—Ç —Å—Ä–µ–¥ –º–µ—Ç–∞–ª–∏—Ç–µ: —Ä–µ–ª–∞—Ç–∏–≤–∏—Å—Ç–∫–∏—Ç–µ –µ—Ñ–µ–∫—Ç–∏ –ø—Ä–æ–º–µ–Ω—è—Ç –Ω–∞—á–∏–Ω–∞, –ø–æ –∫–æ–π—Ç–æ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ –∞–±—Å–æ—Ä–±–∏—Ä–∞—Ç —Å–≤–µ—Ç–ª–∏–Ω–∞—Ç–∞.
–ì–ª–∞–≤–æ–±–ª—ä—Å–∫–∞–Ω–∏—Ü–∞—Ç–∞ –Ω–∞ F-–±–ª–æ–∫–∞
–ì—Ä—É–ø–∞ 3 —Å—ä–¥—ä—Ä–∂–∞ –¥–≤–∞ –µ–ª–µ–º–µ–Ω—Ç–∞, –∫–æ–∏—Ç–æ –º–æ–≥–∞—Ç –¥–∞ –±—ä–¥–∞—Ç –Ω–∞ –¥—Ä—É–≥–æ –º—è—Å—Ç–æ. –ö–æ–≥–∞—Ç–æ —Å–µ –¥–≤–∏–∂–∏–º –≤ –≥–æ—Ä–Ω–∏—Ç–µ —Ä–µ–¥–æ–≤–µ –Ω–∞ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞, –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ –∑–∞–ø—ä–ª–≤–∞—Ç –æ–±–≤–∏–≤–∫–∏—Ç–µ –≤ –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª–Ω–æ—Å—Ç—Ç–∞ –æ—Ç —Ç–∞–∫–∞ –Ω–∞—Ä–µ—á–µ–Ω–∏—Ç–µ –æ—Ä–±–∏—Ç–∞–ª–∏, –∏–∑—á–∞–∫–≤–∞–π–∫–∏, –¥–æ–∫–∞—Ç–æ –Ω–∞–π-–≤—ä—Ç—Ä–µ—à–Ω–∞—Ç–∞ –æ–±–≤–∏–≤–∫–∞ –µ –ø—ä–ª–Ω–∞ –ø—Ä–µ–¥–∏ –¥–∞ –∑–∞–ø–æ—á–Ω–µ –¥–∞ —Å–µ –∑–∞–ø—ä–ª–≤–∞ —Å–ª–µ–¥–≤–∞—â–∞—Ç–∞. –û—Ç –µ–ª–µ–º–µ–Ω—Ç 57, –ª–∞–Ω—Ç–∞–Ω, –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ –∑–∞–ø–æ—á–≤–∞—Ç –¥–∞ –≤–ª–∏–∑–∞—Ç –≤ –Ω–æ–≤ —Ç–∏–ø –æ—Ä–±–∏—Ç–∞–ª–∞, f-–æ—Ä–±–∏—Ç–∞–ª–∞. –ó–∞ –¥–∞ —Å–µ –æ—Ç—á–µ—Ç–µ —Ç–æ–≤–∞, –ø–æ–≤–µ—á–µ—Ç–æ –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∏ —Ç–∞–±–ª–∏—Ü–∏ –∏–∑—Ä—è–∑–≤–∞—Ç –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ, —Å—ä—Å—Ç–∞–≤–ª—è–≤–∞—â–∏ —Ç–æ–∑–∏ f-–±–ª–æ–∫, –ø–æ—Å—Ç–∞–≤—è–π–∫–∏ –≥–æ –ø–æ–¥ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞, –æ—Å—Ç–∞–≤—è–π–∫–∏ –ø—Ä–∞–∑–Ω–∞ –∫–ª–µ—Ç–∫–∞ –≤ –≥—Ä—É–ø–∞ 3.
–°–ø—Ä–∞–≤–µ–¥–ª–∏–≤–æ —Ä–µ—à–µ–Ω–∏–µ. –ù–æ –∏–º–∞ —Å–ø–æ—Ä –∑–∞ —Ç–æ–≤–∞ –∫–æ–π –æ—Ç –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –≤ f-–±–ª–æ–∫–∞ —Ç—Ä—è–±–≤–∞ –¥–∞ –¥–æ–π–¥–µ –Ω–∞ –ø—ä—Ä–≤–æ –º—è—Å—Ç–æ. –ù—è–∫–æ–∏ —Ö–∏–º–∏—Ü–∏ —Ç–≤—ä—Ä–¥—è—Ç, —á–µ —Ä–µ—à–µ–Ω–∏–µ—Ç–æ —Ç—Ä—è–±–≤–∞ –¥–∞ —Å–µ —Å—ä–æ–±—Ä–∞–∑–∏ —Å –∫–æ–Ω—Ñ–∏–≥—É—Ä–∞—Ü–∏—è—Ç–∞ –Ω–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏—Ç–µ, –∫–æ–µ—Ç–æ –æ–∑–Ω–∞—á–∞–≤–∞, —á–µ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞ —â–µ —Å–∏ –æ—Å—Ç–∞–Ω–µ —Ç–∞–∫–∞–≤–∞, –∫–∞–∫–≤–∞—Ç–æ –µ, —Å –ª–∞–Ω—Ç–∞–Ω –∏ –∞–∫—Ç–∏–Ω–∏–π –≤ –ª—è–≤–∞—Ç–∞ —á–∞—Å—Ç –Ω–∞ f-–±–ª–æ–∫–∞. –î—Ä—É–≥–∏ –∏–∑—Ç—ä–∫–≤–∞—Ç, —á–µ —Ö–∏–º–∏—á–Ω–∏—Ç–µ —Å–≤–æ–π—Å—Ç–≤–∞ –∫–∞—Ç–æ –∞—Ç–æ–º–Ω–∏—è —Ä–∞–¥–∏—É—Å –∏ —Ç–æ—á–∫–∞—Ç–∞ –Ω–∞ —Ç–æ–ø–µ–Ω–µ —Å–∞ –ø–æ-–¥–æ–±—ä—Ä –∫—Ä–∏—Ç–µ—Ä–∏–π.
–ü—Ä–µ–∑ 2016 –≥. –ú–µ–∂–¥—É–Ω–∞—Ä–æ–¥–Ω–∏—è—Ç —Å—ä—é–∑ –∑–∞ —á–∏—Å—Ç–∞ –∏ –ø—Ä–∏–ª–æ–∂–Ω–∞ —Ö–∏–º–∏—è —Å—Ñ–æ—Ä–º–∏—Ä–∞ —Ä–∞–±–æ—Ç–Ω–∞ –≥—Ä—É–ø–∞ –∑–∞ —É—Ä–µ–∂–¥–∞–Ω–µ –Ω–∞ —Å–ø–æ—Ä–∞. –ù–æ –Ω–∏–∫–æ–π –Ω–µ –æ—á–∞–∫–≤–∞ —Ä–µ—à–µ–Ω–∏–µ —Å–∫–æ—Ä–æ.
–î–∞ –∑–∞–ø–æ—á–Ω–µ–º –æ—Ç–Ω–∞—á–∞–ª–æ
–í—Å–∏—á–∫–∏ —Ç–µ–∑–∏ –Ω–µ–¥–æ—Ä–∞–∑—É–º–µ–Ω–∏—è —Å–∞ —É–±–µ–¥–∏–ª–∏ –Ω—è–∫–æ–∏ —Ö–∏–º–∏—Ü–∏, —á–µ —Ç—Ä—è–±–≤–∞ –¥–∞ —Å–µ –ø—Ä–µ–Ω–∞—á–µ—Ä—Ç–∞–µ –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ - –∏ –Ω—è–º–∞ –Ω–µ–¥–æ—Å—Ç–∏–≥ –Ω–∞ –∏–¥–µ–∏. –ú–∞—Ä–∫ –õ–∏–π—á (Mark Leach) –æ—Ç Manchester Metropolitan University, –í–µ–ª–∏–∫–æ–±—Ä–∏—Ç–∞–Ω–∏—è, –ø–æ–¥–¥—ä—Ä–∂–∞ –∏–Ω—Ç–µ—Ä–Ω–µ—Ç –±–∞–∑–∞ –¥–∞–Ω–Ω–∏ —Å –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∏ —Ç–∞–±–ª–∏—Ü–∏,¬Ý–∫–æ—è—Ç–æ —Å—ä–¥—ä—Ä–∂–∞ —Å—Ç–æ—Ç–∏—Ü–∏ –≤–µ—Ä—Å–∏–∏.

–í –æ–ø–∏—Ç –¥–∞ –ø—Ä–µ–¥—Å—Ç–∞–≤–∏ –ø–æ-–¥–æ–±—Ä–µ –Ω–µ–ø—Ä–µ–∫—ä—Å–Ω–∞—Ç–æ—Å—Ç—Ç–∞, –∫–æ—è—Ç–æ —Å–µ–≥–∞ —Å–µ –ø—Ä–µ–∫—ä—Å–≤–∞ –Ω–∞ –≤—Å–µ–∫–∏ —Ä–µ–¥, –ø–µ–Ω—Å–∏–æ–Ω–∏—Ä–∞–Ω–∏—è—Ç –∫–∞–Ω–∞–¥—Å–∫–∏ —Ö–∏–º–∏–∫ –§–µ—Ä–Ω–∞–Ω–¥–æ –î—é—Ñ—É—Ä (Fernando Dufour) —Ä–∞–∑—Ä–∞–±–æ—Ç–≤–∞ 3D –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞ —Å–∏—Å—Ç–µ–º–∞, –∫–æ—è—Ç–æ –ø—Ä–∏–ª–∏—á–∞ –Ω–∞ –∫–æ–ª–µ–¥–Ω–∞ –µ–ª—Ö–∞, –∫–∞—Ç–æ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –∏–∑–ª–∏–∑–∞—Ç –æ—Ç —Å—Ç–≤–æ–ª–∞ –≤ –∫—Ä—ä–≥–æ–≤–µ, –∫–æ–∏—Ç–æ —Å—Ç–∞–≤–∞—Ç –≤—Å–µ –ø–æ-–≥–æ–ª–µ–º–∏, –ø—Ä–∏–±–ª–∏–∂–∞–≤–∞–π–∫–∏ —Å–µ –¥–æ –æ—Å–Ω–æ–≤–∞—Ç–∞.
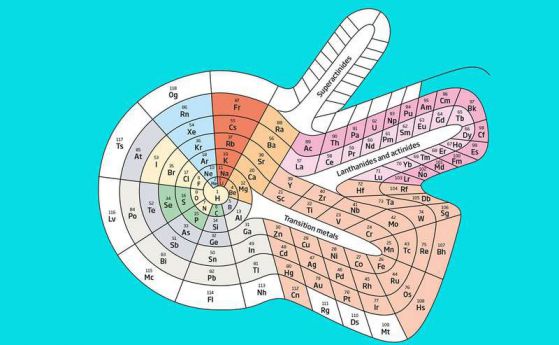
–ê–ª—Ç–µ—Ä–Ω–∞—Ç–∏–≤–∞ –µ —Å–ø–∏—Ä–∞–ª–∞—Ç–∞, —Ä–∞–∑—Ä–∞–±–æ—Ç–µ–Ω–∞ –æ—Ç –¢–∏–æ–¥–æ—Ä –ë–µ–Ω—Ñ–∏ (Theodor Benfey), –∫–æ—è—Ç–æ –ø–æ–∑–≤–æ–ª—è–≤–∞ –Ω–∞ f-–±–ª–æ–∫–∞ –¥–∞ —Å–µ –∏–∑—Ç–æ—á–∏ –Ω–∞–≤—ä–Ω (–∏–∑–æ–±—Ä–∞–∂–µ–Ω–∏–µ—Ç–æ –Ω–∞–π-–≥–æ—Ä–µ).
–ï—Ä–∏–∫ –°–∫–µ—Ä–∏ (Eric Scerri) –æ—Ç –£–Ω–∏–≤–µ—Ä—Å–∏—Ç–µ—Ç–∞ –Ω–∞ –ö–∞–ª–∏—Ñ–æ—Ä–Ω–∏—è –≤ –õ–æ—Å –ê–Ω–¥–∂–µ–ª–∏—Å –µ —Å—Ä–µ–¥ –æ–Ω–µ–∑–∏, –∫–æ–∏—Ç–æ –Ω–∞—Å—Ç–æ—è–≤–∞—Ç –∑–∞ –ø–æ-—Ñ—É–Ω–¥–∞–º–µ–Ω—Ç–∞–ª–Ω–∏ –ø—Ä–æ–º–µ–Ω–∏. –ü—Ä–µ–¥–∏ –≤—Ä–µ–º–µ —Ç–æ–π –ø—Ä–µ–¥–ª–æ–∂–∏ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞ –¥–∞ –±—ä–¥–µ –ø–æ–¥—Ä–µ–¥–µ–Ω–∞ —Ç–∞–∫–∞, —á–µ –¥–∞ –º–∞–∫—Å–∏–º–∏–∑–∏—Ä–∞ –±—Ä–æ—è –Ω–∞ ‚Äû—Ç—Ä–∏–∞–¥–∏—Ç–µ‚Äú, –≥—Ä—É–ø–∏ –æ—Ç —Ç—Ä–∏ –µ–ª–µ–º–µ–Ω—Ç–∞, –∫–æ–∏—Ç–æ –∏–º–∞—Ç —Å—Ö–æ–¥–Ω–∏ —Å–≤–æ–π—Å—Ç–≤–∞ –∏ —Å–∞ —Å–≤—ä—Ä–∑–∞–Ω–∏ —Å —Ç–µ—Ö–Ω–∏—Ç–µ –∞—Ç–æ–º–Ω–∏ —Ç–µ–≥–ª–∞. (–ê—Ç–æ–º–Ω–æ —Ç–µ–≥–ª–æ –µ —Å—Ä–µ–¥–Ω–∞—Ç–∞ –º–∞—Å–∞ –Ω–∞ –≤—Å–∏—á–∫–∏ –æ—Ç –µ—Å—Ç–µ—Å—Ç–≤–µ–Ω–æ —Å—ä—â–µ—Å—Ç–≤—É–≤–∞—â–∏ –∏–∑–æ—Ç–æ–ø–∏ –Ω–∞ –¥–∞–¥–µ–Ω –µ–ª–µ–º–µ–Ω—Ç, –∑–∞ —Ä–∞–∑–ª–∏–∫–∞ –æ—Ç –∞—Ç–æ–º–Ω–∞—Ç–∞¬Ý–º–∞—Å–∞, –∫–æ—è—Ç–æ –µ –æ–±—â–∞—Ç–∞ –º–∞—Å–∞ –Ω–∞ –ø—Ä–æ—Ç–æ–Ω–∏—Ç–µ –∏ –Ω–µ—É—Ç—Ä–æ–Ω–∏—Ç–µ –≤ –µ–¥–∏–Ω –∞—Ç–æ–º –∏–ª–∏ –∏–∑–æ—Ç–æ–ø)
–°–µ–≥–∞¬Ý–°–∫–µ—Ä–∏ –µ –∑–∞ –æ—â–µ –ø–æ-–¥—Ä–∞—Å—Ç–∏—á–µ–Ω –ø–æ–¥—Ö–æ–¥: —Ç–∞–±–ª–∏—Ü–∞—Ç–∞ –¥–∞ –µ –Ω–µ –Ω–∞ 18, –∞ –Ω–∞ 32 –∫–æ–ª–æ–Ω–∏, –∫–∞—Ç–æ —Å–µ –ø–æ—Å—Ç–∞–≤—è—Ç –≤—Å–∏—á–∫–∏—Ç–µ 30 –µ–ª–µ–º–µ–Ω—Ç–∞ –æ—Ç¬Ý f-–±–ª–æ–∫–∞ –º–µ–∂–¥—É —Å–µ–≥–∞—à–Ω–∏–∏—Ç–µ –≥—Ä—É–ø–∏ 2 –∏ 3 (Going long). –¢–æ–≤–∞ –ø–æ–∑–≤–æ–ª—è–≤–∞ –∞—Ç–æ–º–Ω–∏—è—Ç –Ω–æ–º–µ—Ä –¥–∞ —Å–µ –ø—Ä–µ–¥—Å—Ç–∞–≤–∏ –≤ –Ω–µ–ø—Ä–µ–∫—ä—Å–Ω–∞—Ç–∞ –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª–Ω–æ—Å—Ç.
–ù–æ –ì–∏–ª–µ—Ä–º–æ –Ý–µ—Å—Ç—Ä–µ–ø–æ¬Ý(Guillermo Restrepo) –æ—Ç –ò–Ω—Å—Ç–∏—Ç—É—Ç–∞ –ø–æ –º–∞—Ç–µ–º–∞—Ç–∏–∫–∞ –∫—ä–º –æ–±—â–µ—Å—Ç–≤–æ—Ç–æ –ú–∞–∫—Å –ü–ª–∞–Ω–∫, –ì–µ—Ä–º–∞–Ω–∏—è, –ø—Ä–µ–¥–ø–æ—á–∏—Ç–∞ –∞–ª—Ç–µ—Ä–Ω–∞—Ç–∏–≤–Ω–æ —Ä–µ—à–µ–Ω–∏–µ. –¢–æ–π –∏–∑—Å–ª–µ–¥–≤–∞ –¥–∞–ª–∏ —Ö–∏–º–∏—á–µ—Å–∫–æ—Ç–æ —Å—Ö–æ–¥—Å—Ç–≤–æ –Ω–∞ –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –≤ —Å—ä—â–∏—Ç–µ –∫–æ–ª–æ–Ω–∏ –≤—Å–µ –æ—â–µ —Å–µ –∑–∞–ø–∞–∑–≤–∞ –∫–∞–∫—Ç–æ –ø—Ä–µ–¥–∏ 150 –≥–æ–¥–∏–Ω–∏, –ø—Ä–µ–¥–≤–∏–¥ –Ω–æ–≤–∏—Ç–µ –∑–Ω–∞–Ω–∏—è –∑–∞ —Ö–∏–º–∏—á–µ—Å–∫–∞—Ç–∞ —Ä–µ–∞–∫—Ç–∏–≤–Ω–æ—Å—Ç. –ù–µ–≥–æ–≤–æ—Ç–æ –∑–∞–∫–ª—é—á–µ–Ω–∏–µ –µ, —á–µ –ª–∞–Ω—Ç–∞–Ω—ä—Ç –ø—Ä–∏–Ω–∞–¥–ª–µ–∂–∏ –∫—ä–º –≥—Ä—É–ø–∞ 3 - —Ç–æ–µ—Å—Ç, –∏–∑–≤—ä–Ω –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª–Ω–æ—Å—Ç—Ç–∞.
–¢–æ–º –°–ø–µ–π—Å (Tom Space) –ø—Ä–µ–¥–ª–∞–≥–∞¬Ý—Ç–∞–±–ª–∏—Ü–∞, —Ä–∞–∑–≤–∏–≤–∞—â–∞ —Å–µ –≤ 6 –∏–∑–º–µ—Ä–µ–Ω–∏—è - –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ —Å–∞ –ø–æ–¥—Ä–µ–¥–µ–Ω–∏ –ø–æ –æ–±–µ–º–Ω–∏ –ø–µ—Ä–∏–æ–¥–∏ –Ω–∞ —Å—Ä–µ–¥–Ω–∏—Ç–µ¬Ý—Å–∏ –∞—Ç–æ–º–Ω–∏¬Ý–º–∞—Å–∏:
–ü—Ä–µ–ø—Ä–æ–µ–∫—Ç–∏—Ä–∞–Ω–µ—Ç–æ –Ω–∞ –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ –º–æ–∂–µ –¥–∞ –∏–∑–≥–ª–µ–∂–¥–∞ –∫–∞—Ç–æ —É—Ç–æ–ø–∏—á–Ω–æ —Ç—ä—Ä—Å–µ–Ω–µ, –Ω–æ —Å–∫–æ—Ä–æ –º–æ–∂–µ –¥–∞ —Å—Ç–∞–Ω–µ –Ω–µ–æ—Ç–ª–æ–∂–Ω–æ. –í–µ—á–µ¬Ý–æ—á–∞–∫–≤–∞–º–µ –¥–∞ –±—ä–¥–µ —Å–∏–Ω—Ç–µ–∑–∏—Ä–∞–Ω –µ–ª–µ–º–µ–Ω—Ç 119.¬Ý–ö—ä–¥–µ —â–µ –æ—Ç–∏–¥–µ –∏ –∫–∞–∫ —â–µ —Å–µ –ø—Ä–µ–æ–±—Ä–∞–∑–∏ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞, –∑–∞ –¥–∞ –Ω–∞–ø—Ä–∞–≤–∏ –º—è—Å—Ç–æ –∑–∞ –Ω–µ–≥–æ, –æ—Å—Ç–∞–≤–∞ –¥–∞ —Å–µ –≤–∏–¥–∏.
–û—â–µ –ø–æ —Ç–µ–º–∞—Ç–∞

–§–∏–∑–∏–∫–∞
–ö–æ–Ω–∫—É—Ä—Å –∑–∞ –µ—Å–µ—Ç–∞ –Ω–∞ —É—á–µ–Ω–∏—Ü–∏ –∏ —Å—Ç—É–¥–µ–Ω—Ç–∏ –Ω–∞ —Ç–µ–º–∞ "–ü–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Å–∏—Å—Ç–µ–º–∞ –Ω–∞ –î. –ò. –ú–µ–Ω–¥–µ–ª–µ–µ–≤"

–§–∏–∑–∏–∫–∞
–ù–∞–º–µ—Ä–µ–Ω –µ –Ω–∞–π-—Å—Ç–∞—Ä–∏—è—Ç –µ–∫–∑–µ–º–ø–ª—è—Ä –Ω–∞ –ø–µ—Ä–∏–æ–¥–∏—á–Ω–∞—Ç–∞ —Ç–∞–±–ª–∏—Ü–∞ –Ω–∞ –ú–µ–Ω–¥–µ–ª–µ–µ–≤

–ù–æ–≤–∏–Ω–∏
–ù–∞ 6 —Ñ–µ–≤—Ä—É–∞—Ä–∏ 1886 –µ –æ—Ç–∫—Ä–∏—Ç –µ–ª–µ–º–µ–Ω—Ç—ä—Ç –≥–µ—Ä–º–∞–Ω–∏–π, –ø—Ä–µ–¥–≤–∏–¥–µ–Ω –æ—Ç –ú–µ–Ω–¥–µ–ª–µ–µ–≤


















–ö–æ–º–µ–Ω—Ç–∞—Ä–∏
–ú–æ–ª—è, —Ä–µ–≥–∏—Å—Ç—Ä–∏—Ä–∞–π—Ç–µ —Å–µ –æ—Ç T–£–ö!
–ê–∫–æ –≤–µ—á–µ –∏–º–∞—Ç–µ —Ä–µ–≥–∏—Å—Ç—Ä–∞—Ü–∏—è, –Ω–∞—Ç–∏—Å–Ω–µ—Ç–µ –¢–£–ö!
21919
1
02.03 2019 –≤ 12:52
–ö–∞—Ç–æ —Å—Ä–µ–¥—Å—Ç–≤–æ –∑–∞ —Å–∏—Å—Ç–µ–º–∞—Ç–∏–∫–∞ –≤ –æ–±—É—á–µ–Ω–∏–µ—Ç–æ, —Ç—Ä–∞–¥–∏—Ü–∏–æ–Ω–Ω–∏—è—Ç –≤–∏–¥ –Ω–∞ —Ç–∞–±–ª–∏—Ü–∞—Ç–∞ (—Å–≤–∏—Ç –∏–ª–∏ —Ä–∞–∑–≥—ä—Ä–Ω–∞—Ç) –∏–ª—é—Å—Ç—Ä–∏—Ä–∞ –æ—Ç–Ω–æ—à–µ–Ω–∏—è—Ç–∞ –º–µ–∂–¥—É –µ–ª–µ–º–µ–Ω—Ç–∏—Ç–µ –¥–æ—Å—Ç–∞—Ç—ä—á–Ω–æ –¥–æ–±—Ä–µ. 32-–µ–ª–µ–º–µ–Ω—Ç–Ω–∏—Ç–µ –ø–µ—Ä–∏–æ–¥–∏ —Å–∞ –Ω–µ—É–¥–æ–±–Ω–∏ –∑–∞ —Ä–∏—Å—É–≤–∞–Ω–µ –∏ –≥—É–±—è—Ç –ª–æ–≥–∏–∫–∞—Ç–∞ –Ω–∞ –∫—ä—Å–∏—Ç–µ –ø–µ—Ä–∏–æ–¥–∏ –≥–æ—Ä–µ. –°–ø–∏—Ä–∞–ª–∞—Ç–∞ –µ –Ω—è–∫–∞–∫—ä–≤ –∫–æ–º–ø—Ä–æ–º–∏—Å –º–µ–∂–¥—É —Ç—Ä–∏—Ç–µ - –Ω–æ –ø—ä–∫ –∏–∑–∏—Å–∫–≤–∞ –æ—Å–æ–±–µ–Ω–∞ –Ω–∞–≥–ª–∞—Å–∞ –Ω–∞ —É–º–∞ –∑–∞ –∑–∞–ø–æ–º–Ω—è–Ω–µ.
–û—Å—Ç–∞–Ω–∞–ª–∏—Ç–µ –∏–¥–µ–∏ –º–æ–≥–∞—Ç –¥–∞ —Å–µ –æ–±–æ–±—â—è—Ç –ø–æ–¥ –∫–∞—Ç–µ–≥–æ—Ä–∏—è—Ç–∞ "—â–æ–º –≥–∏ –≤–ª–µ—á–µ...".
–ü–æ—Å–ª–µ–¥–Ω–∏ –∫–æ–º–µ–Ω—Ç–∞—Ä–∏
Johnny B Goode
–ü—Ä–µ—Å—Ç–∏–∂–Ω–∞ –Ω–∞–≥—Ä–∞–¥–∞ –æ—Ç –ë–ê–ù —Å–ø–µ—á–µ–ª–∏ –≥–ª–∞–≤–Ω–∏—è—Ç —Ä–µ–¥–∞–∫—Ç–æ—Ä –Ω–∞ –ù–∞—É–∫–∞OFFNews
Gunteer
–ü—Ä–µ—Å—Ç–∏–∂–Ω–∞ –Ω–∞–≥—Ä–∞–¥–∞ –æ—Ç –ë–ê–ù —Å–ø–µ—á–µ–ª–∏ –≥–ª–∞–≤–Ω–∏—è—Ç —Ä–µ–¥–∞–∫—Ç–æ—Ä –Ω–∞ –ù–∞—É–∫–∞OFFNews
–•—Ä–∏—Å—Ç–∏—è–Ω–∏–Ω
–¢–æ–≤–∞ –µ –∫—Ä–∞–ª—è—Ç –Ω–∞ —Ç–∏–∫–≤–∏—Ç–µ: –¢–∏–∫–≤–∞—Ç–∞ –º—É —Ç–µ–∂–∏ –Ω–∞–¥ –µ–¥–∏–Ω –µ–¥–∏–Ω —Ç–æ–Ω
dolivo
–°–∞—Ö–∞—Ä–∞ –æ—á–∞–∫–≤–∞ 75% —É–≤–µ–ª–∏—á–µ–Ω–∏–µ –Ω–∞ –≤–∞–ª–µ–∂–∏—Ç–µ –¥–æ 2100 –≥.
dolivo
–ó–µ–º–Ω–∞—Ç–∞ —è–±—ä–ª–∫–∞: —Å—Ç–∞—Ä–∞ –∫—É–ª—Ç—É—Ä–∞ –∑–∞ –Ω–æ–≤–∏—Ç–µ –∫–ª–∏–º–∞—Ç–∏—á–Ω–∏ –≤—Ä–µ–º–µ–Ω–∞