
Изследователи успяха да разбият бариерата на атомната разделителна способност и да изобразят отделни атоми в протеин.
Това е огромна стъпка напред, благодарение на прогреса в т.нар. криоелектронна микроскопия, която никога досега не е успявала да създаде изображения с толкова висока разделителна способност.
Криоелектронната микроскопия направи светкавична революция в структурната биология, откакто бе разработена от трима учени, удостоени с Нобелова награда за химия за това си постижение през 2017 г. Оттогава подобренията в технологията на електронните лъчи заедно с оптимизацията на софтуера й позволиха да навлезе по-дълбоко от всякога в молекулярните структури.
Вникването в атомната структура на протеините ще доведе до значителен напредък в проучването на клетъчните процеси.
Понастоящем технологията изпреварва по-широко използваната рентгенова кристалография, сложен процес, за чието изпълнение понякога са нужни месеци, а за някои протеини може изобщо да не създаде изображение.
За да се изобразят протеини с такива детайли, криоелектронната микроскопия изисква доста ниски температури. След вземане на образеца протеини и охлаждането му до криогенни температури (около -200 ° C), върху пробата се прилага електронен лъч. Нормалната електронна микроскопия изисква сложна подготовка на пробата, но при криоелектронната микроскопия всичко, което е необходимо, е образецът да бъде замразен в твърдо състояние. Електроните бомбардират пробата и се връщат обратно в детектор, който след това изпраща данните на компютърен софтуер, за да ги осмисли. Софтуерът съставя окончателното изображение за изучаване на структурата на протеина.
Екипът вече успя да изобрази протеин с толкова висока разделителна способност, че ясно се виждат всички атоми в него. За първи път отделни атоми в протеинова структура могат да бъдат ясно разграничени в изображение, създадено от криоелектронен микроскоп.
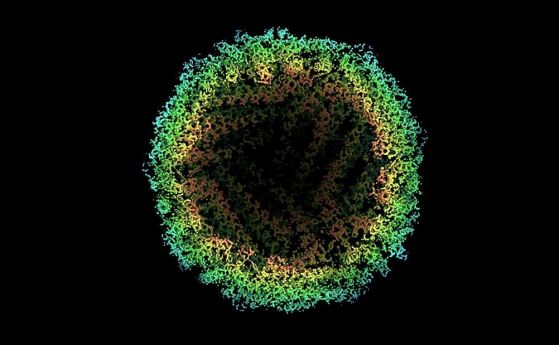
 Отделните атоми, картографирани с помощта на криоелектронна микроскопия (cryo-EM), показващи реконструирана плътност на апоферитин. Кредит: Paul Emsley/MRC Laboratory of Molecular Biology
Отделните атоми, картографирани с помощта на криоелектронна микроскопия (cryo-EM), показващи реконструирана плътност на апоферитин. Кредит: Paul Emsley/MRC Laboratory of Molecular Biology
Протеинът, наречен апоферитин (среща се и като феритин, молекула, съдържаща желязо), заснетото изображение имаше удивителна разделителна способност от 1,25 Å (ангстрьома - разбивайки предишните рекорди от 1,54 ангстрьома. Апоферитинът се използва в криоелектронната микроскопия поради изключителната си стабилност и се е превърнал в надеждна тестова проба за технологията.
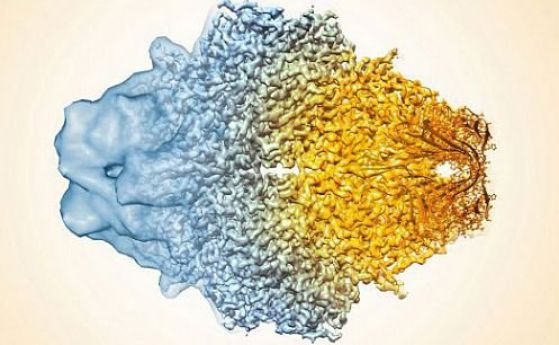
 Реконструкция на целия апоферитинов капсид. Кредит: Paul Emsley/MRC Laboratory of Molecular Biology
Реконструкция на целия апоферитинов капсид. Кредит: Paul Emsley/MRC Laboratory of Molecular Biology
Тъй като пробивите в технологията продължават, възможностите са безкрайни по отношение на това как криоелектронната микроскопия ще оформи структурната биология. Изглежда обаче, че са достигнати границата на възможностите на текущата итерация. Според Холгер Старк (Holger Stark), биохимик от Института по биофизична химия на Макс Планк, че след последните открития бъдещите подобрения са ограничени.
„Под 1 Å е почти невъзможно да се достигне преди с криоелектронна микроскопия“, заявява Старк за Nature. Получаването на такава структура със съществуваща модерна технология би отнело „няколкостотин години запис на данни и нереалистично количество изчислителна мощност и капацитет за съхранение на данни“.
Справка:
-
Yip, K. M., Fischer, N., Paknia, E., Chari, A. & Stark, H. Preprint at bioRxiv https://doi.org/10.1101/2020.05.21.106740 (2020).
-
Nakane, T. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.05.22.110189 (2020).
Източник:
Revolutionary Microscopy Technique Images Atoms Within A Protein For The First Time, IFLScience
















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон