

–¶–≤–Ķ—ā–ĺ–≤–Ķ—ā–Ķ —Ā–į –Ĺ–į–≤—Ā—Ź–ļ—ä–ī–Ķ –ĺ–ļ–ĺ–Ľ–ĺ –Ĺ–į—Ā, –Ĺ–ĺ –Ņ–ĺ—á—ā–ł –≤—Ā–ł—á–ļ–ł —á–ł—Ā—ā–ł —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —Ā–į –Ī–Ķ–Ľ–ł. –Ę–ĺ–≤–į –Ĺ–Ķ –Ķ –ł–∑–Ĺ–Ķ–Ĺ–į–ī–≤–į—Č–ĺ, –ļ–ĺ–≥–į—ā–ĺ —Ā–Ķ –∑–Ĺ–į–Ķ –ļ–į–ļ–≤–ĺ –Ķ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ī–į —Ā–Ķ –Ĺ–į–Ņ—Ä–į–≤–ł –Ĺ–Ķ—Č–ĺ —Ü–≤–Ķ—ā–Ĺ–ĺ, –Ņ–ł—ą–Ķ –Ę–Ķ–ĺ–ī–ĺ—Ä –ď—Ä–Ķ–Ļ (Theodore Gray).
–°–į–ľ–ĺ –Ĺ—Ź–ļ–ĺ–Ľ–ļ–ĺ –Ņ—Ä–ł—Ä–ĺ–ī–Ĺ–ł –≤–Ķ—Č–Ķ—Ā—ā–≤–į –ł–ľ–į—ā —ā–į–ļ–į–≤–į —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–į —Ā—ā—Ä—É–ļ—ā—É—Ä–į, –ļ–ĺ—Ź—ā–ĺ –ł–ľ–į —Ā–≤–ĺ–Ļ—Ā—ā–≤–ĺ—ā–ĺ –ī–į —É—Ā–≤–ĺ—Ź–≤–į –≤–ł–ī–ł–ľ–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į.
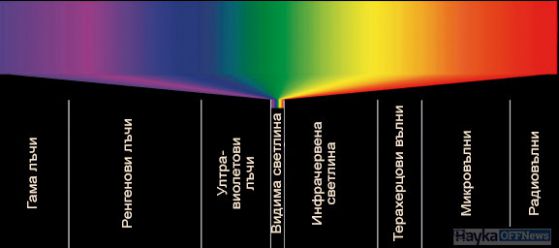
–Ď—Ź–Ľ–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –Ķ —Ā–ľ–Ķ—Ā –ĺ—ā –≤—Ā–ł—á–ļ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ –ł –ļ–ĺ–≥–į—ā–ĺ –ļ–į–∑–≤–į–ľ–Ķ, —á–Ķ –Ķ–ī–Ĺ–ĺ —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł–Ķ –Ķ —Ü–≤–Ķ—ā–Ĺ–ĺ, –ł–ľ–į–ľ–Ķ –Ņ—Ä–Ķ–ī–≤–ł–ī, —á–Ķ —ā–ĺ –ĺ—ā—Ä–į–∑—Ź–≤–į –Ķ–ī–ł–Ĺ —Ü–≤—Ź—ā –ĺ—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į (–ļ–ĺ–Ķ—ā–ĺ —Ā—ä–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–į –Ĺ–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į —Ā –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–į –ī—ä–Ľ–∂–ł–Ĺ–į –Ĺ–į –≤—ä–Ľ–Ĺ–į—ā–į) –Ņ–ĺ-—Ā–ł–Ľ–Ĺ–ĺ –ĺ—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į –Ĺ–į –ī—Ä—É–≥–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ.
–Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä, –į–ļ–ĺ –Ķ–ī–Ĺ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į –Ņ–ĺ–≥–Ľ—ä—Č–į –Ņ—Ä–Ķ–ī–ł–ľ–Ĺ–ĺ —Ā–ł–Ĺ—Ź —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į, —Ā–Ľ–Ķ–ī —ā–ĺ–≤–į —ā—Ź —Č–Ķ –ł–∑–≥–Ľ–Ķ–∂–ī–į –∂—ä–Ľ—ā–į, –∑–į—Č–ĺ—ā–ĺ –ĺ—ā—Ä–į–∑—Ź–≤–į –Ņ–ĺ–≤–Ķ—á–Ķ –∂—ä–Ľ—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į, –į —Ā–ł–Ĺ—Ź—ā–į —Ā–Ķ –Ņ–ĺ–≥–Ľ—ä—Č–į. –Ě–ĺ –≤–ł–ī–ł–ľ–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –ĺ–Ī—Ö–≤–į—Č–į —Ā–į–ľ–ĺ –Ķ–ī–Ĺ–į –ľ–į–Ľ–ļ–į —á–į—Ā—ā –ĺ—ā —Ü–Ķ–Ľ–ł—Ź –ī–ł–į–Ņ–į–∑–ĺ–Ĺ –ĺ—ā –≤—ä–∑–ľ–ĺ–∂–Ĺ–ł –ī—ä–Ľ–∂–ł–Ĺ–ł –Ĺ–į –≤—ä–Ľ–Ĺ–ł—ā–Ķ. ¬†
 |
| –Ě–ł–Ķ –≤–ł–∂–ī–į–ľ–Ķ —Ā–į–ľ–ĺ —ā–Ķ–∑–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł, –ļ–ĺ–ł—ā–ĺ –Ņ–ĺ–≥–Ľ—ä—Č–į—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –ĺ—ā –≤–ł–ī–ł–ľ–ł—Ź —Ā–Ņ–Ķ–ļ—ā—ä—Ä. |
–ē–ī–Ĺ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į –ľ–ĺ–∂–Ķ –ī–į –Ņ–ĺ–≥–Ľ—ä—Č–į —Ą–ĺ—ā–ĺ–Ĺ–ł –ĺ—ā —Ü–Ķ–Ľ–ł—Ź –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–ľ–į–≥–Ĺ–ł—ā–Ķ–Ĺ —Ā–Ņ–Ķ–ļ—ā—ä—Ä - –ĺ—ā —Ä–į–ī–ł–ĺ–≤—ä–Ľ–Ĺ–ł –ī–ĺ —Ä–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–≤–ł –Ľ—ä—á–ł, –Ĺ–ĺ —ā—Ź —Č–Ķ –Ī—ä–ī–Ķ –ĺ—Ü–≤–Ķ—ā–Ķ–Ĺ–į, —Ā–į–ľ–ĺ –į–ļ–ĺ –ł–ľ–į —Ä–į–∑–Ľ–ł–ļ–į –≤ –Ņ–ĺ–≥–Ľ—ä—Č–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –Ķ–ī–Ĺ–į –≤–ł–ī–ł–ľ–į –ī—ä–Ľ–∂–ł–Ĺ–į –Ĺ–į –≤—ä–Ľ–Ĺ–į—ā–į —Ā–Ņ—Ä—Ź–ľ–ĺ –ī—Ä—É–≥–į.
–ė —ā–ĺ–≤–į —Ā–Ķ –ĺ–ļ–į–∑–≤–į –ī–ĺ—Ā—ā–į –Ĺ–Ķ–ĺ–Ī–ł—á–į–Ļ–Ĺ–ĺ.¬†–ü–ĺ–≤–Ķ—á–Ķ—ā–ĺ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ņ–ĺ–≥–Ľ—ä—Č–į—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į —Ā–į–ľ–ĺ –Ĺ–į–ī –≤–ł–ī–ł–ľ–ł—Ź —Ā–Ņ–Ķ–ļ—ā—ä—Ä, –≤ —É–Ľ—ā—Ä–į–≤–ł–ĺ–Ľ–Ķ—ā–ĺ–≤–ł—Ź –ī–ł–į–Ņ–į–∑–ĺ–Ĺ.
–Ě–į–Ļ-—Ź—Ä–ļ–ł, –Ī–ĺ–≥–į—ā–ł –ł —Ä–į–∑–Ĺ–ĺ–ĺ–Ī—Ä–į–∑–Ĺ–ł –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ–ł –ł–ī–≤–į—ā –ĺ—ā —Ā–Ņ–Ķ—Ü–ł–į–Ľ–Ĺ–ł –ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł (—ā.–Ķ. –Ĺ–į –≤—ä–≥–Ľ–Ķ—Ä–ĺ–ī–Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į) —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź, –ļ–į–ļ—ā–ĺ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ł, —ā–į–ļ–į –ł —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ĺ–ł.
–ö–į–ļ —Ā–Ķ –Ņ–ĺ–Ľ—É—á–į–≤–į —Ü–≤–Ķ—ā–į
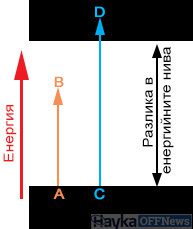
–ü—Ä–Ķ–∑ 1913 –≥. –Ě–ł–Ľ—Ā –Ď–ĺ—Ä –Ņ—Ä–ł–Ľ–į–≥–į –ļ–≤–į–Ĺ—ā–ĺ–≤–į—ā–į –ł–ī–Ķ—Ź –ļ—ä–ľ –ļ–Ľ–į—Ā–ł—á–Ķ—Ā–ļ–ł—Ź –Ņ–Ľ–į–Ĺ–Ķ—ā–į—Ä–Ķ–Ĺ –ľ–ĺ–ī–Ķ–Ľ –Ĺ–į –į—ā–ĺ–ľ–į. –ė–ī–Ķ—Ź—ā–į –ľ—É –Ķ, —á–Ķ –į—ā–ĺ–ľ—ä—ā –Ņ–ĺ –Ĺ–ł–ļ–į–ļ—ä–≤ –Ĺ–į—á–ł–Ĺ –Ĺ–Ķ –Ņ—Ä–ł–Ľ–ł—á–į –Ĺ–į –ļ–Ľ–į—Ā–ł—á–Ķ—Ā–ļ–į—ā–į –ľ–Ķ—Ö–į–Ĺ–ł—á–Ĺ–į —Ā–ł—Ā—ā–Ķ–ľ–į, –ļ–ĺ—Ź—ā–ĺ –ľ–ĺ–∂–Ķ –ī–į –Ņ–ĺ–≥–Ľ—ä—Č–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź –Ĺ–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–Ľ–Ĺ–ĺ –ľ–į–Ľ–ļ–ł –Ņ–ĺ—Ä—Ü–ł–ł.–ě—ā —Ą–į–ļ—ā–į –Ĺ–į —Ā—ä—Č–Ķ—Ā—ā–≤—É–≤–į–Ĺ–Ķ—ā–ĺ –Ĺ–į —ā–Ķ—Ā–Ĺ–ł —Ā–Ņ–Ķ–ļ—ā—Ä–į–Ľ–Ĺ–ł –Ľ–ł–Ĺ–ł–ł –Ĺ–į –į–Ņ–ĺ–≥–Ľ—ä—Č–į–Ĺ–Ķ –ł –ł–∑–Ľ—ä—á–≤–į–Ĺ–Ķ –ĺ—ā –Ķ–ī–Ĺ–į —Ā—ā—Ä–į–Ĺ–į –ł –Ĺ–į —Ö–ł–Ņ–ĺ—ā–Ķ–∑–į—ā–į –Ĺ–į –ź–Ļ–Ĺ—Č–į–Ļ–Ĺ –∑–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–Ĺ–ł –ļ–≤–į–Ĺ—ā–ł –ĺ—ā –ī—Ä—É–≥–į —Ā—ā—Ä–į–Ĺ–į, –Ď–ĺ—Ä –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł–Ľ, —á–Ķ –į—ā–ĺ–ľ—ä—ā –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –Ĺ–į–ľ–ł—Ä–į —Ā–į–ľ–ĺ –≤ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł –ī–ł—Ā–ļ—Ä–Ķ—ā–Ĺ–ł —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ł —Ā—ä—Ā—ā–ĺ—Ź–Ĺ–ł—Ź —Ā –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź E0, E1, E2 ‚Ķ
–ö–ĺ–≥–į—ā–ĺ –į—ā–ĺ–ľ—ä—ā –ł–∑–Ľ—ä—á–≤–į –ł–Ľ–ł –Ņ–ĺ–≥–Ľ—ä—Č–į –ļ–≤–į–Ĺ—ā –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–ľ–į–≥–Ĺ–ł—ā–Ĺ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź (—Ą–ĺ—ā–ĺ–Ĺ), –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—ä—ā¬†–Ņ—Ä–į–≤–ł –Ņ—Ä–Ķ—Ö–ĺ–ī –ĺ—ā –Ķ–ī–Ĺ–ĺ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ —Ā—ä—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ –≤ –ī—Ä—É–≥–ĺ.
–ź–ļ–ĺ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—ä—ā¬†–Ņ–ĺ–≥—ä–Ľ–Ĺ–Ķ —Ą–ĺ—ā–ĺ–Ĺ, –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź—ā–į –Ĺ–į –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–į —Ā–Ķ —É–≤–Ķ–Ľ–ł—á–į–≤–į —Ā—ä—Ā —Ā—ā–ĺ–Ļ–Ĺ–ĺ—Ā—ā, —Ä–į–≤–Ĺ–į –Ĺ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź—ā–į –Ĺ–į –į–Ī—Ā–ĺ—Ä–Ī–ł—Ä–į–Ĺ–ł—Ź —Ą–ĺ—ā–ĺ–Ĺ.
–ó–į –ī–į —Ā—ā–į–Ĺ–Ķ —ā–į–ļ–ĺ–≤–į –Ņ–ĺ–≥–Ľ—ä—Č–į–Ĺ–Ķ, —ā—Ä—Ź–Ī–≤–į –ī–į —Ā—ä—Č–Ķ—Ā—ā–≤—É–≤–į –Ĺ–Ķ–∑–į–Ķ—ā–ĺ —Ā—ä—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ —Ā –Ņ–ĺ-–≤–ł—Ā–ĺ–ļ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź, –ļ—ä–ī–Ķ—ā–ĺ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—ä—ā –ľ–ĺ–∂–Ķ –ī–į –ĺ—ā–ł–ī–Ķ. –ź–ļ–ĺ —ā–ĺ–≤–į —É—Ā–Ľ–ĺ–≤–ł–Ķ –Ĺ–Ķ –Ķ –Ĺ–į–Ľ–ł—Ü–Ķ, —Ą–ĺ—ā–ĺ–Ĺ—ä—ā –Ĺ–Ķ –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –į–Ī—Ā–ĺ—Ä–Ī–ł—Ä–į –ł —Č–Ķ –Ņ—Ä–ĺ–ī—ä–Ľ–∂–ł –ī–≤–ł–∂–Ķ–Ĺ–ł–Ķ—ā–ĺ —Ā–ł. –Ę–ĺ–≤–į –ĺ–Ī—Ź—Ā–Ĺ—Ź–≤–į –∑–į—Č–ĺ –Ĺ—Ź–ļ–ĺ–ł —ā–Ķ–Ľ–į —Ā–į –Ņ—Ä–ĺ–∑—Ä–į—á–Ĺ–ł –∑–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į, –į –ī—Ä—É–≥–ł - –Ĺ–Ķ.
–§–ĺ—ā–ĺ–Ĺ–ł—ā–Ķ —Ā –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź AB (—Ā—ā–ĺ–Ļ–Ĺ–ĺ—Ā—ā—ā–į –Ĺ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź—ā–į —Ā—ä–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–į –Ĺ–į –ī—ä–Ľ–∂–ł–Ĺ–į—ā–į –Ĺ–į –ĺ—ā—Ā–Ķ—á–ļ–į—ā–į AB) —Ā–į –Ņ–ĺ-–ľ–į–Ľ–ļ–ł –ĺ—ā —ą–ł—Ä–ĺ—á–ł–Ĺ–į—ā–į –Ĺ–į –Ņ—Ä–ĺ–Ľ—É–ļ–į—ā–į¬†–ľ–Ķ–∂–ī—É –∑–į–Ķ—ā–ł –ł –Ĺ–Ķ–∑–į–Ķ—ā–ł –Ĺ–ł–≤–į –ł –Ĺ–Ķ –ľ–ĺ–≥–į—ā –ī–į –Ī—ä–ī–į—ā –Ņ–ĺ–≥—ä–Ľ–Ĺ–į—ā–ł¬†–ĺ—ā –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–į –ļ–į—ā–ĺ –Ĺ—Ź–ľ–į —ā–į–ļ–ł–≤–į –ļ—Ä–į–Ļ–Ĺ–ł —Ā—ä—Ā—ā–ĺ—Ź–Ĺ–ł—Ź, –≤ –ļ–ĺ–ł—ā–ĺ —ā–Ķ –Ī–ł—Ö–į –ľ–ĺ–≥–Ľ–ł –ī–į –Ņ—Ä–Ķ–ľ–ł–Ĺ–į—ā. –Ę–į–ļ–ł–≤–į —Ą–ĺ—ā–ĺ–Ĺ–ł –Ņ—Ä–Ķ–ľ–ł–Ĺ–į–≤–į—ā –Ņ—Ä–Ķ–∑ –≤–Ķ—Č–Ķ—Ā—ā–≤–ĺ—ā–ĺ. –ź–ļ–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź—ā–į –Ĺ–į —Ą–ĺ—ā–ĺ–Ĺ–į –Ĺ–į–ī–≤–ł—ą–į–≤–į —ą–ł—Ä–ł–Ĺ–į—ā–į –Ĺ–į –Ņ—Ä–ĺ–Ľ—É–ļ–į—ā–į (CD –Ĺ–į —Ā—Ö–Ķ–ľ–į—ā–į), —ā–Ķ–∑–ł —Ą–ĺ—ā–ĺ–Ĺ–ł —Ā–Ķ –Ņ–ĺ–≥–Ľ—ä—Č–į—ā –ĺ—ā –≤–Ķ—Č–Ķ—Ā—ā–≤–ĺ—ā–ĺ.
–ě—Ä–≥–į–Ĺ–ł—á–Ĺ–ł—ā–Ķ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ņ–ĺ–≥–Ľ—ä—Č–į—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į, –ļ–ĺ–≥–į—ā–ĺ –Ķ–ī–ł–Ĺ —Ą–ĺ—ā–ĺ–Ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–į —Ā –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł—ā–Ķ –ĺ—Ā–ł–≥—É—Ä—Ź–≤–į—Č–ł —Ü–Ķ–Ľ–ĺ—Ā—ā—ā–į –Ĺ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į—ā–į, –≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ –ł–∑–ī–ł–≥–į–Ļ–ļ–ł –≥–ĺ –Ĺ–į –ī—Ä—É–≥–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł–Ļ–Ĺ–ĺ –Ĺ–ł–≤–ĺ (–į–ļ–ĺ —ā–ĺ–≤–į –Ķ –≤—ä–∑–ľ–ĺ–∂–Ĺ–ĺ). –ē–Ĺ–Ķ—Ä–≥–ł–Ļ–Ĺ–į—ā–į —Ā—ā–ĺ–Ļ–Ĺ–ĺ—Ā—ā –Ĺ–į —Ą–ĺ—ā–ĺ–Ĺ–į –∑–į–≤–ł—Ā–ł –ĺ—ā —Ü–≤–Ķ—ā–į –ľ—É –ł —Ä–į–∑–Ľ–ł—á–Ĺ–ł—ā–Ķ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–į—ā –Ņ–ĺ—Ä–į–∑–Ķ–Ĺ–ł –ĺ—ā —Ä–į–∑–Ľ–ł—á–Ĺ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ –Ĺ–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į, –≤ –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā –ĺ—ā —ā–ĺ–≤–į –ļ–ĺ–Ľ–ļ–ĺ —Ā–ł–Ľ–Ĺ–ĺ —ā–Ķ–∑–ł –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł —Ā–į –ĺ–Ī–≤—ä—Ä–∑–į–Ĺ–ł –≤ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į—ā–į.
–¶–≤–Ķ—ā—ä—ā —Ā—ä–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–į –Ĺ–į —Ö–ł–ľ–ł—Ź—ā–į
–ß–Ķ—Ä–≤–Ķ–Ĺ–ł—ā–Ķ —Ą–ĺ—ā–ĺ–Ĺ–ł –ĺ—ā –≤–ł–ī–ł–ľ–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –ł–ľ–į—ā –Ĺ–į–Ļ-–ľ–į–Ľ–ļ–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź, —Ā–Ľ–Ķ–ī–≤–į–Ĺ–ł –ĺ—ā –∑–Ķ–Ľ–Ķ–Ĺ–ł—ā–Ķ, —Ā–Ľ–Ķ–ī —ā–ĺ–≤–į —Ā–ł–Ĺ–ł—ā–Ķ –ł –Ĺ–į–Ļ-–Ĺ–į–ļ—Ä–į—Ź –≤–ł–ĺ–Ľ–Ķ—ā–ĺ–≤–ł—ā–Ķ —Ą–ĺ—ā–ĺ–Ĺ–ł, –ļ–ĺ–ł—ā–ĺ –ł–ľ–į—ā –Ĺ–į–Ļ-–ľ–Ĺ–ĺ–≥–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź –≤—ä–≤ –≤–ł–ī–ł–ľ–ł—Ź —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–Ķ–Ĺ –ī–ł–į–Ņ–į–∑–ĺ–Ĺ. –£–Ľ—ā—Ä–į–≤–ł–ĺ–Ľ–Ķ—ā–ĺ–≤–ł—ā–Ķ —Ą–ĺ—ā–ĺ–Ĺ–ł –ł–ľ–į—ā –ĺ—Č–Ķ –Ņ–ĺ–≤–Ķ—á–Ķ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź.¬†–†–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–≤–ł—ā–Ķ –Ľ—ä—á–ł —Ā–į —Ą–ĺ—ā–ĺ–Ĺ–ł —Ā —ā–ĺ–Ľ–ļ–ĺ–≤–į –ľ–Ĺ–ĺ–≥–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź, —á–Ķ —á–Ķ—Ā—ā–ĺ –ī–ĺ—Ä–ł –Ĺ–Ķ –≥–ł –Ĺ–į—Ä–ł—á–į–ľ–Ķ —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į.
–ē–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł—ā–Ķ, –ļ–ĺ–ł—ā–ĺ —Ā–į –ĺ–Ī–≤—ä—Ä–∑–į–Ĺ–ł –ľ–Ĺ–ĺ–≥–ĺ –∑–ī—Ä–į–≤–ĺ –ľ–ĺ–≥–į—ā –ī–į —Ā–Ķ –ĺ—ā–ļ—ä—Ā–Ĺ–į—ā —Ā–į–ľ–ĺ –ĺ—ā –≤–ł—Ā–ĺ–ļ–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł–Ļ–Ĺ–į —É–Ľ—ā—Ä–į–≤–ł–ĺ–Ľ–Ķ—ā–ĺ–≤–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –ł–Ľ–ł –ī–ĺ—Ä–ł –ĺ—ā —Ä–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–≤–ł –Ľ—ä—á–ł.¬†–ē–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł—ā–Ķ –≤ –Ņ–ĺ–≤–Ķ—á–Ķ—ā–ĺ —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —Ā–į –ĺ–Ī–≤—ä—Ä–∑–į–Ĺ–ł –ľ–Ĺ–ĺ–≥–ĺ –∑–ī—Ä–į–≤–ĺ, –ļ–ĺ–Ķ—ā–ĺ –Ķ –ł –Ņ—Ä–ł—á–ł–Ĺ–į—ā–į –Ņ–ĺ–≤–Ķ—á–Ķ—ā–ĺ —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź –ī–į —Ā–į –Ī–Ķ–Ľ–ł.¬†–Ě–ĺ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ –ľ–ĺ–≥–į—ā –ī–į –Ī—ä–ī–į—ā –Ņ–ĺ—Ā—ā—Ä–ĺ–Ķ–Ĺ–ł —ā–į–ļ–į, —á–Ķ –ĺ–Ī–≤—ä—Ä–∑–≤–į—Č–į—ā–į —Ā–ł–Ľ–į –ī–į –Ī—ä–ī–Ķ —ā–į–ļ–į–≤–į, –ļ–į–ļ–≤–į—ā–ĺ –≤–ł —ā—Ä—Ź–Ī–≤–į, –≤ —ā–ĺ–≤–į —á–ł—Ā–Ľ–ĺ, –ł–∑–Ī–ł—Ä–į—ā–Ķ–Ľ–Ĺ–ĺ –ī–į –Ņ–ĺ–≥–Ľ—ä—Č–į—ā –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–Ĺ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ –Ĺ–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į.
–ė–ľ–į –Ĺ—Ź–ļ–ĺ–Ľ–ļ–ĺ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ł —Ā—ā—Ä—É–ļ—ā—É—Ä–ł —Ā –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł —Ā –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ł—Ź –ī–ł–į–Ņ–į–∑–ĺ–Ĺ –Ĺ–į –ĺ–Ī–≤—ä—Ä–∑–≤–į—Č–į—ā–į —Ā–ł–Ľ–į. –Ę–Ķ —Ā–į –≤ —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ–ł—ā–Ķ.¬†–ß—Ä–Ķ–∑ –Ņ—Ä–ĺ–ľ—Ź–Ĺ–į –Ĺ–į —Ā–≤—ä—Ä–∑–≤–į—Č–į—ā–į —Ā–ł–Ľ–į (–ł –Ņ–ĺ —ā–ĺ–∑–ł –Ĺ–į—á–ł–Ĺ –ł –Ĺ–į —Ü–≤–Ķ—ā–į) –Ĺ–į –į—ā–ĺ–ľ–ł—ā–Ķ, —Ä–į–∑–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł –ĺ–ļ–ĺ–Ľ–ĺ –į–ļ—ā–ł–≤–Ĺ–ł—Ź —Ü–Ķ–Ĺ—ā—ä—Ä, –ī–į–ī–Ķ–Ĺ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –Ĺ–į—Ā—ā—Ä–ĺ–Ķ–Ĺ–į –Ĺ–į –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ —Ü–≤—Ź—ā –≤—ä–≤ –≤–ł–ī–ł–ľ–ł—Ź —Ā–Ņ–Ķ–ļ—ā—ä—Ä.
–ē—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į - –ł–Ĺ–ī–ł–≥–ĺ

–ē–ī–Ĺ–ĺ –ĺ—ā –Ņ—ä—Ä–≤–ł—ā–Ķ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į, –ł–Ĺ–ī–ł–≥–ĺ—ā–ĺ (–Ņ–ĺ-–≥–ĺ—Ä–Ķ) –Ņ—Ä–ł–ī–į–≤–į —Ā–ł–Ĺ—Ć–ĺ—ā–ĺ –Ĺ–į –ī—ä–Ĺ–ļ–ł—ā–Ķ. –Ę–ĺ –ī—ä–Ľ–∂–ł —Ü–≤–Ķ—ā–į —Ā–ł –Ĺ–į –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—ā –ĺ—ā —ā—Ä–ł –ī–≤–ĺ–Ļ–Ĺ–ł –≤—Ä—ä–∑–ļ–ł –≤ –Ĺ–Ķ–≥–ĺ–≤–ł—Ź —Ü–Ķ–Ĺ—ā—ä—Ä (O = C, C = C, C = O).¬†–ē–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ł—ā–Ķ –ľ–ĺ–≥–į—ā –ī–į –ľ–ł–≥—Ä–ł—Ä–į—ā –ľ–Ķ–∂–ī—É —ā–Ķ–∑–ł –ī–≤–ĺ–Ļ–Ĺ–ł –≤—Ä—ä–∑–ļ–ł, –ļ–ĺ–≥–į—ā–ĺ —Ā–į —É–ī–į—Ä–Ķ–Ĺ–ł —Ā –Ņ—Ä–į–≤–ł–Ľ–Ĺ–ĺ—ā–ĺ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź, —Ā—ä–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–į—Č–ĺ –Ĺ–į –ĺ—Ä–į–Ĺ–∂–Ķ–≤–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į. –ü–ĺ–≥–Ľ—ä—Č–į —Ā–Ķ –ĺ—Ä–į–Ĺ–∂–Ķ–≤–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į –ł –ĺ—Ā—ā–į–≤–į —Ā–ł–Ĺ—Ź—ā–į –ł–Ĺ–ī–ł–≥–ĺ —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į.
–Ę–į—Ä—ā—Ä–į–∑–ł–Ĺ

–Ę–į—Ä—ā—Ä–į–∑–ł–Ĺ—ä—ā –Ķ –Ķ–ī–ł–Ĺ –ĺ—ā —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ĺ–ł—ā–Ķ —Ö—Ä–į–Ĺ–ł—ā–Ķ–Ľ–Ĺ–ł –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ–ł, –ĺ—ā–≥–ĺ–≤–ĺ—Ä–Ĺ–ł –∑–į —Ź—Ä–ļ–ł—ā–Ķ –Ĺ—é–į–Ĺ—Ā–ł –Ĺ–į –Ī–Ľ–ł–∑–į–Ľ–ļ–ł—ā–Ķ.¬†–ź–∑–ĺ—ā–Ĺ–į—ā–į –ī–≤–ĺ–Ļ–Ĺ–į –≤—Ä—ä–∑–ļ–į –≤ —Ā—Ä–Ķ–ī–į—ā–į –ľ—É (N = N) –Ņ–ĺ—Ä–į–∂–ī–į –Ĺ–Ķ–≥–ĺ–≤–ł—Ź —Ź—Ä—ä–ļ –ĺ—Ä–į–Ĺ–∂–Ķ–≤ —Ü–≤—Ź—ā.
–ü–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ķ–Ĺ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ —Ā –ľ–Ĺ–ĺ–≥–ĺ –ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į –ļ–į—ā–ĺ –ł–Ĺ–ī–ł–≥–ĺ—ā–ĺ –ł —ā–į—Ä—ā—Ä–į–∑–ł–Ĺ–į –Ķ, —á–Ķ —ā–Ķ –ł–∑—Ā–≤–Ķ—ā–Ľ—Ź–≤–į—ā —Ā —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ĺ–į –≤—Ä–Ķ–ľ–Ķ—ā–ĺ, —ā—ä–Ļ –ļ–į—ā–ĺ —Ą–į–ļ—ā—ä—ā, —á–Ķ —ā–Ķ –Ņ–ĺ–≥–Ľ—ä—Č–į—ā –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź—ā–į –Ĺ–į –≤–ł–ī–ł–ľ–į—ā–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į - –≤–ľ–Ķ—Ā—ā–ĺ –ī–į —Ź –ĺ—ā—Ä–į–∑—Ź–≤–į—ā, –Ņ—Ä–Ķ—á—É–Ņ–≤–į—ā –ł–Ľ–ł –ł–∑—Ü—Ź–Ľ–ĺ –ī–į —Ź –ł–≥–Ĺ–ĺ—Ä–ł—Ä–į—ā, –ĺ–∑–Ĺ–į—á–į–≤–į, —á–Ķ —Ā–į —É—Ź–∑–≤–ł–ľ–ł –ĺ—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į.¬†–¶–≤–Ķ—ā—ä—ā –ł–ľ —Ā–Ķ –ī—ä–Ľ–∂–ł –Ĺ–į –ī–Ķ–Ľ–ł–ļ–į—ā–Ĺ–ł —Ö–ł–ľ–ł—á–Ĺ–ł —Ā—ā—Ä—É–ļ—ā—É—Ä–ł –ł —Ā–ł –ĺ—ā–ł–≤–į, –į–ļ–ĺ —ā–Ķ–∑–ł —Ā—ā—Ä—É–ļ—ā—É—Ä–ł —Ā–Ķ —Ä–į–∑–Ī–ł—Ź—ā.
–Ě–ĺ –ł–ľ–į –ł –ī—Ä—É–≥ –Ĺ–į—á–ł–Ĺ, —Ā –ļ–ĺ–Ļ—ā–ĺ –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –Ņ–ĺ—Ā—ā–ł–≥–Ĺ–Ķ —Ā–Ķ–Ľ–Ķ–ļ—ā–ł–≤–Ŗ嬆–Ņ–ĺ–≥–Ľ—ä—Č–į–Ĺ–Ķ –Ĺ–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į: —á—Ä–Ķ–∑ –Ĺ–ł–≤–į—ā–į –Ĺ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—Ź, –≥–Ķ–Ĺ–Ķ—Ä–ł—Ä–į–Ĺ–ł –ĺ—ā –ļ—Ä–ł—Ā—ā–į–Ľ–Ĺ–ł—ā–Ķ —Ā—ā—Ä—É–ļ—ā—É—Ä–ł –Ĺ–į –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł—ā–Ķ —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź. –Ę–Ķ —Ā–į –Ņ–ĺ—á—ā–ł –Ĺ–į–Ņ—ä–Ľ–Ĺ–ĺ –∑–į—Ā—ā—Ä–į—Ö–ĺ–≤–į–Ĺ–ł —Ā—Ä–Ķ—Č—É –Ņ–ĺ–≤—Ä–Ķ–ī–ł –ĺ—ā —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į.¬†–Ē–ĺ—Ä–ł –į–ļ–ĺ —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į—ā–į –ł–∑–ľ–Ķ—Ā—ā–≤–į –į—ā–ĺ–ľ–ł –ĺ—ā –ļ—ä–ī–Ķ—ā–ĺ –ł–ľ –Ķ –ľ—Ź—Ā—ā–ĺ—ā–ĺ, —ā–Ķ –Ĺ–Ķ –ľ–ĺ–≥–į—ā –ī–į –ĺ—ā–ł–ī–į—ā –ī–į–Ľ–Ķ—á–Ķ.¬†–õ–ĺ–≥–ł–ļ–į—ā–į –Ĺ–į –ļ—Ä–ł—Ā—ā–į–Ľ–į –ī–ł–ļ—ā—É–≤–į, —á–Ķ —ā–Ķ —Č–Ķ –Ņ–ĺ–Ņ–į–ī–Ĺ–į—ā –ĺ–Ī—Ä–į—ā–Ĺ–ĺ –≤ –ľ—Ź—Ā—ā–ĺ—ā–ĺ, –ĺ—ā –ļ–ĺ–Ķ—ā–ĺ –ł–ī–≤–į—ā, —ā–į–ļ–į —á–Ķ —Ü–≤–Ķ—ā—ä—ā –ĺ—Ā—ā–į–≤–į.¬†
–¶–≤–Ķ—ā–ĺ–≤–Ķ—ā–Ķ –Ĺ–į –ļ—Ä–ł—Ā—ā–į–Ľ–ł—ā–Ķ –ĺ—Ā—ā–į–≤–į—ā –∑–į–≤–ł–Ĺ–į–≥–ł
–ü—ä—Ä–≤–ł—ā–Ķ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł, –ļ–į—ā–ĺ –ĺ—Ö—Ä–į—ā–į —Ā–į —Ā—ä—Ā —Ā–ł–≥—É—Ä–Ĺ–ĺ—Ā—ā —Ā–į —Ā–≤–Ķ—ā–Ľ–ĺ—É—Ā—ā–ĺ–Ļ—á–ł–≤–ł - —ā–Ķ –≤—Ā–Ķ –ĺ—Č–Ķ —Ā–Ķ –≤–ł–∂–ī–į—ā –≤ –Ņ–Ķ—Č–Ķ—Ä–Ĺ–ł—ā–Ķ —Ä–ł—Ā—É–Ĺ–ļ–ł, –Ĺ–į–Ņ—Ä–į–≤–Ķ–Ĺ–ł –ĺ—ā –Ņ—ä—Ä–≤–ł—ā–Ķ —Ö–ĺ—Ä–į.¬†–Ę–Ķ–∑–ł –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł —Ā–į –Ī–į–∑–ł—Ä–į–Ĺ–ł –Ĺ–į –ļ—Ä–ł—Ā—ā–į–Ľ–Ĺ–į —Ā—ā—Ä—É–ļ—ā—É—Ä–į, –Ĺ–į—Ä–Ķ—á–Ķ–Ĺ–į –∂–Ķ–Ľ–Ķ–∑–Ķ–Ĺ –ĺ–ļ—Ā–ł–ī, –Ņ–ĺ-–ł–∑–≤–Ķ—Ā—ā–Ķ–Ĺ –ļ–į—ā–ĺ —Ä—ä–∂–ī–į.¬†
–ě—Ö—Ä–į—ā–į, –Ĺ–į–Ļ-—Ā–≤–Ķ—ā–Ľ–ł—Ź—ā —Ü–≤—Ź—ā, –Ķ –Ņ–ĺ—á—ā–ł —á–ł—Ā—ā –∂–Ķ–Ľ–Ķ–∑–Ķ–Ĺ –ĺ–ļ—Ā–ł–ī.¬†–†–į–∑–Ľ–ł—á–Ĺ–ł –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –ľ–į–≥–Ĺ–Ķ–∑–ł–Ķ–≤ –ĺ–ļ—Ā–ł–ī (MgO), —Ā–ľ–Ķ—Ā–Ķ–Ĺ —Ā –∂–Ķ–Ľ–Ķ–∑–Ķ–Ĺ –ĺ–ļ—Ā–ł–ī –Ņ—Ä–į–≤—Ź—ā —Ü–≤–Ķ—ā–ĺ–≤–Ķ—ā–Ķ —Ā–ł–Ķ–Ĺ–į –ł —ą–ĺ–ļ–ĺ–Ľ–į–ī–ĺ–≤–į—ā–į —É–ľ–Ī—Ä–į.
 –ě—Ö—Ä–į—ā–į —Ā–Ķ –ī–ĺ–Ī–ł–≤–į –ĺ—ā –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ĺ –ĺ—Ü–≤–Ķ—ā–Ķ–Ĺ–ł –≥–Ľ–ł–Ĺ–ł, —Ā—ä–ī—ä—Ä–∂–į—Č–ł –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–Ĺ–ł –ĺ–ļ—Ā–ł–ī–ł. –Ę—Ź –Ķ —Ā—Ä–Ķ–ī –Ĺ–į–Ļ-—Ā—ā–į—Ä–ł—ā–Ķ –Ī–į–≥—Ä–ł–Ľ–į, –ł–∑–≤–Ķ—Ā—ā–Ĺ–ł –Ĺ–į —á–ĺ–≤–Ķ—á–Ķ—Ā—ā–≤–ĺ—ā–ĺ, –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ĺ–ł –ĺ—ā —Ö–ł–Ľ—Ź–ī–ł –≥–ĺ–ī–ł–Ĺ–ł –∑–į –Ī–ĺ—Ź–ī–ł—Ā–≤–į–Ĺ–Ķ –Ĺ–į —ā—ä–ļ–į–Ĺ–ł, —ā—Ź–Ľ–ĺ, –ī–Ķ–ļ–ĺ—Ä–į—Ü–ł–ł, —Ü–Ķ—Ä–Ķ–ľ–ĺ–Ĺ–ł–į–Ľ–Ĺ–ł –Ņ—Ä–į–ļ—ā–ł–ļ–ł, –ļ–į–ļ—ā–ĺ –ł –∑–į –∑–į–Ņ–į–∑–≤–į–Ĺ–Ķ –Ĺ–į –∂–ł–≤–ĺ—ā–Ĺ–ł –ļ–ĺ–∂–ł.
–ě—Ö—Ä–į—ā–į —Ā–Ķ –ī–ĺ–Ī–ł–≤–į –ĺ—ā –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ĺ –ĺ—Ü–≤–Ķ—ā–Ķ–Ĺ–ł –≥–Ľ–ł–Ĺ–ł, —Ā—ä–ī—ä—Ä–∂–į—Č–ł –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–Ĺ–ł –ĺ–ļ—Ā–ł–ī–ł. –Ę—Ź –Ķ —Ā—Ä–Ķ–ī –Ĺ–į–Ļ-—Ā—ā–į—Ä–ł—ā–Ķ –Ī–į–≥—Ä–ł–Ľ–į, –ł–∑–≤–Ķ—Ā—ā–Ĺ–ł –Ĺ–į —á–ĺ–≤–Ķ—á–Ķ—Ā—ā–≤–ĺ—ā–ĺ, –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ĺ–ł –ĺ—ā —Ö–ł–Ľ—Ź–ī–ł –≥–ĺ–ī–ł–Ĺ–ł –∑–į –Ī–ĺ—Ź–ī–ł—Ā–≤–į–Ĺ–Ķ –Ĺ–į —ā—ä–ļ–į–Ĺ–ł, —ā—Ź–Ľ–ĺ, –ī–Ķ–ļ–ĺ—Ä–į—Ü–ł–ł, —Ü–Ķ—Ä–Ķ–ľ–ĺ–Ĺ–ł–į–Ľ–Ĺ–ł –Ņ—Ä–į–ļ—ā–ł–ļ–ł, –ļ–į–ļ—ā–ĺ –ł –∑–į –∑–į–Ņ–į–∑–≤–į–Ĺ–Ķ –Ĺ–į –∂–ł–≤–ĺ—ā–Ĺ–ł –ļ–ĺ–∂–ł.
 –ü—Ä–į–ł—Ā—ā–ĺ—Ä–ł—á–Ķ—Ā–ļ–ł —Ä–ł—Ā—É–Ĺ–ļ–ł –≤¬†–Ņ–Ķ—Č–Ķ—Ä–į—ā–į Font-de-Gaume¬†–≤ —é–∂–Ĺ–į—ā–į —á–į—Ā—ā –Ĺ–į –§—Ä–į–Ĺ—Ü–ł—Ź
–ü—Ä–į–ł—Ā—ā–ĺ—Ä–ł—á–Ķ—Ā–ļ–ł —Ä–ł—Ā—É–Ĺ–ļ–ł –≤¬†–Ņ–Ķ—Č–Ķ—Ä–į—ā–į Font-de-Gaume¬†–≤ —é–∂–Ĺ–į—ā–į —á–į—Ā—ā –Ĺ–į –§—Ä–į–Ĺ—Ü–ł—Ź
–Ě–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł—ā–Ķ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł —Ā–į —Ā–≤–Ķ—ā–Ľ–ĺ—É—Ā—ā–ĺ–Ļ—á–ł–≤–ł, –Ĺ–ĺ —Ā–į–ľ–ĺ –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ –Ĺ–į–Ī–ĺ—Ä –ĺ—ā —Ü–≤–Ķ—ā–ĺ–≤–Ķ - —Ā–Ņ–Ķ—Ü–ł–į–Ľ–Ĺ–ĺ –Ĺ–Ķ–ī–ĺ—Ā—ā–ł–≥–į—ā —Ź—Ä–ļ–ł, —Ā–ł–Ľ–Ĺ–ĺ –Ĺ–į—Ā–ł—ā–Ķ–Ĺ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ.¬†–ú–Ĺ–ĺ–≥–ĺ –ĺ—ā —ā–Ķ–∑–ł, –ļ–ĺ–ł—ā–ĺ —Ā—ä—Č–Ķ—Ā—ā–≤—É–≤–į—ā, —Ā–į –ľ–Ķ—ā–į–Ľ–Ĺ–ł —Ā–ĺ–Ľ–ł –ł –ĺ–ļ—Ā–ł–ī–ł, –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ł –ĺ—ā —Ā–ľ–ł–Ľ–į–Ĺ–Ķ—ā–ĺ –Ĺ–į —Ź—Ä–ļ–ĺ –ĺ—Ü–≤–Ķ—ā–Ķ–Ĺ–ł –ļ–į–ľ—ä–Ĺ–ł.
¬† –ö–į–ľ—ä–ļ—ä—ā –Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā
–ö–į–ľ—ä–ļ—ä—ā –Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā
 –ü–ł–≥–ľ–Ķ–Ĺ—ā—ä—ā —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ, –ī–ĺ–Ī–ł–≤–į–Ĺ –ĺ—ā –ļ–į–ľ—ä–ļ–į¬†–Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā
–ü–ł–≥–ľ–Ķ–Ĺ—ā—ä—ā —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ, –ī–ĺ–Ī–ł–≤–į–Ĺ –ĺ—ā –ļ–į–ľ—ä–ļ–į¬†–Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā
–Ē—Ä—É–≥–ĺ—ā–ĺ –ł–ľ–Ķ –∑–į —Ź—Ä–ļ–ĺ –ĺ—Ü–≤–Ķ—ā–Ķ–Ĺ–ł—ā–Ķ –ļ–į–ľ—ä–Ĺ–ł –Ķ "—Ā–ļ—ä–Ņ–ĺ—Ü–Ķ–Ĺ–Ĺ–ł –ļ–į–ľ—ä–Ĺ–ł" –ł–Ľ–ł –Ņ–ĺ–Ĺ–Ķ "–Ņ–ĺ–Ľ—É—Ā–ļ—ä–Ņ–ĺ—Ü–Ķ–Ĺ–Ĺ–ł –ļ–į–ľ—ä–Ĺ–ł".¬†–Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä –Ņ–ł–≥–ľ–Ķ–Ĺ—ā—ä—ā —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ, –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ –ĺ—ā –ļ–į–ľ—ä–ļ–į –Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –ľ–Ĺ–ĺ–≥–ĺ —Ā–ļ—ä–Ņ, –ļ–ĺ–Ķ—ā–ĺ –ĺ–Ī—Ź—Ā–Ĺ—Ź–≤–į –∑–į—Č–ĺ –Ĺ—Ź–ļ–ĺ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ —Ā–į –Ī–ł–Ľ–ł –ī–ĺ—Ā—ā—ä–Ņ–Ĺ–ł —Ā–į–ľ–ĺ –∑–į –Ī–ĺ–≥–į—ā–ł—ā–Ķ, –ī–ĺ–ļ–į—ā–ĺ –Ĺ–Ķ –Ķ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ –Ņ—ä–Ľ–Ĺ–ł—Ź —Ā–Ņ–Ķ–ļ—ā—ä—Ä –ĺ—ā —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ĺ–ł –ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į.
–Ě—Ź–ļ–ĺ–ł –ĺ—ā –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ł—ā–Ķ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į —Ā–į —ā–ĺ–ļ—Ā–ł—á–Ĺ–ł - –ļ–į—ā–嬆–į—Ä—Ā–Ķ–Ĺ–ĺ–≤–ł—Ź—ā –ł –ļ–į–ī–ľ–ł–Ķ–≤–ł—Ź—ā —Ā—É–Ľ—Ą–ł–ī. –ė—Ā–ļ—Ä—Ź—Č–ĺ—ā–嬆—Ź—Ä–ļ–ĺ –∂—ä–Ľ—ā–ĺ, —ā.–Ĺ. –ļ–į–ī–ľ–ł–Ķ–≤–ĺ –∂—ä–Ľ—ā–ĺ –Ĺ–į "–°–Ľ—ä–Ĺ—á–ĺ–≥–Ľ–Ķ–ī–ł—ā–Ķ" –Ĺ–į –í–į–Ĺ –ď–ĺ–≥ —Ā–Ķ –ī—ä–Ľ–∂–ł –Ĺ–į —ā–ĺ–ļ—Ā–ł—á–Ĺ–ł—Ź –ł —ā–Ķ–∂—ä–ļ –ľ–Ķ—ā–į–Ľ –ļ–į–ī–ľ–ł–Ļ.


–Ę—Ä–į–ī–ł—Ü–ł–ĺ–Ĺ–Ĺ–ł—ā–Ķ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł, –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ĺ–ł –ĺ—ā –Ņ—Ä–į–ł—Ā—ā–ĺ—Ä–ł—á–Ķ—Ā–ļ–ł—ā–Ķ –Ņ–Ķ—Č–Ķ—Ä–Ĺ–ł —Ö—É–ī–ĺ–∂–Ĺ–ł—Ü–ł –ł –ĺ—ā —Ö—É–ī–ĺ–∂–Ĺ–ł—Ü–ł—ā–Ķ –Ĺ–į –ź–Ĺ—ā–ł—á–Ĺ–ĺ—Ā—ā—ā–į, –ļ–į–ļ—ā–ĺ –ł –Ī–į–≥—Ä–ł–Ľ–į—ā–į, –ļ–ĺ–ł—ā–ĺ —Ā–Ķ –Ņ–ĺ—Ź–≤—Ź–≤–į—ā –≤ –Ņ–į–Ľ–ł—ā—Ä–ł—ā–Ķ –Ĺ–į —Ö—É–ī–ĺ–∂–Ĺ–ł—Ü–ł—ā–Ķ –Ĺ–į –†–Ķ–Ĺ–Ķ—Ā–į–Ĺ—Ā–į, –Ď–į—Ä–ĺ–ļ–į, –†–ĺ–ļ–ĺ–ļ–ĺ –ł –ł–ľ–Ņ—Ä–Ķ—Ā–ł–ĺ–Ĺ–ł—Ā—ā–ł—ā–Ķ —Ā–į –Ņ—Ä–Ķ–ī–ł–ľ–Ĺ–ĺ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–Ĺ–ł.
–•—Ä–ĺ–ľ–ĺ–≤–ĺ—ā–ĺ –∂—ä–Ľ—ā–ĺ, –ĺ—Ä–į–Ĺ–∂–Ķ–≤–ĺ –ł —á–Ķ—Ä–≤–Ķ–Ĺ–ĺ —Ā–į¬†–ĺ—ā –≥—Ä—É–Ņ–į—ā–į –Ĺ–į –Ķ–≤—ā–ł–Ĺ–ł—ā–Ķ –Ņ—Ä–ł—Ä–ĺ–ī–Ĺ–ł –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł, –Ĺ–į–Ņ—Ä–į–≤–Ķ–Ĺ–ł –ĺ—ā –ĺ–Ľ–ĺ–≤–Ķ–Ĺ —Ö—Ä–ĺ–ľ–į—ā, —Ä–į–∑—Ä–į–Ī–ĺ—ā–Ķ–Ĺ–ł –∑–į –Ņ—ä—Ä–≤–ł –Ņ—ä—ā –ĺ–ļ–ĺ–Ľ–ĺ 1800–≥ –ĺ—ā —Ą—Ä–Ķ–Ĺ—Ā–ļ–ł —Ö–ł–ľ–ł–ļ. –Ę–Ķ —Ā—ā–į–≤–į—ā –ľ–Ĺ–ĺ–≥–ĺ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ä–Ĺ–ł –Ņ–ĺ—Ä–į–ī–ł —ā—Ź—Ö–Ĺ–į—ā–į –Ĺ–Ķ–Ņ—Ä–ĺ–∑—Ä–į—á–Ĺ–ĺ—Ā—ā, —Ź—Ä–ļ–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ –ł –Ĺ–ł—Ā–ļ–į —Ü–Ķ–Ĺ–į. –í—ä–Ņ—Ä–Ķ–ļ–ł —ā–ĺ–≤–į, —Ā–ļ–Ľ–ĺ–Ĺ–Ĺ–ĺ—Ā—ā—ā–į –ł–ľ –ī–į –Ņ–ĺ—ā—ä–ľ–Ĺ—Ź–≤–į—ā —Ā —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ĺ–į –≤—Ä–Ķ–ľ–Ķ—ā–ĺ, –≤ —Ā—ä—á–Ķ—ā–į–Ĺ–ł–Ķ —Ā —ā–ĺ–ļ—Ā–ł—á–Ĺ–ĺ—ā–ĺ –ł–ľ —Ā—ä–ī—ä—Ä–∂–į–Ĺ–ł–Ķ –Ĺ–į –ĺ–Ľ–ĺ–≤–ĺ, –Ķ –ī–ĺ–≤–Ķ–Ľ–ĺ –ī–ĺ –∑–į–ľ—Ź–Ĺ–į—ā–į –ł–ľ —Ā¬†–ļ–į–ī–ľ–ł–Ķ–≤–ł —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź.
 –ú–ł–Ĺ–Ķ—Ä–į–Ľ—ä—ā –∂–ł–≤–į—á–Ķ–Ĺ —Ā—É–Ľ—Ą–ł–ī –Ķ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ä–Ķ–Ĺ –ł–∑—ā–ĺ—á–Ĺ–ł–ļ –∑–į —á–Ķ—Ä–≤–Ķ–Ĺ–ĺ-–ĺ—Ä–į–Ĺ–∂–Ķ–≤–ĺ. –í—Ā—ä—Č–Ĺ–ĺ—Ā—ā —ā–Ķ—Ä–ľ–ł–Ĺ–ł—ā–Ķ "—Ü–ł–Ĺ–ĺ–Ī—ä—Ä" –ł "—Ź—Ä–ļ–ĺ—á–Ķ—Ä–≤–Ķ–Ĺ–ĺ" —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į—ā –ļ–į—ā–ĺ —Ā–ł–Ĺ–ĺ–Ĺ–ł–ľ–ł –ł —Ā–Ķ –Ņ—Ä–ł–Ľ–į–≥–į—ā –ļ–į–ļ—ā–ĺ –ļ—ä–ľ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–ł—ā–Ķ —ā–į–ļ–į –ł –∑–į –Ņ–ĺ-–ļ—ä—Ā–Ĺ–ĺ —Ā–ł–Ĺ—ā–Ķ–∑–ł—Ä–į–Ĺ–į—ā–į –Ī–ĺ—Ź –ĺ–ļ–ĺ–Ľ–ĺ 17-—ā–ł –≤–Ķ–ļ. –Ē–ĺ –ļ—Ä–į—Ź –Ĺ–į 18-—ā–ł –≤–Ķ–ļ —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į —Ā–į–ľ–ĺ —Ā–ľ–Ľ—Ź–Ĺ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ –ļ–į—ā–ĺ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ü–ł–Ĺ–ĺ–Ī—ä—Ä –Ķ –Ņ–ĺ—á—ā–ł –ł–∑—Ü—Ź–Ľ–ĺ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä–į–Ĺ–ĺ –ĺ—ā –ļ–ł—ā–į–Ļ—Ü–ł—ā–Ķ. –Ę–ĺ–∑–ł –ľ–ł–Ĺ–Ķ—Ä–į–Ľ –ĺ—Ā—ā–į–≤–į –Ĺ–į–Ļ-–ī–ĺ–Ī—Ä–ł—Ź—ā –ľ–Ķ—ā–ĺ–ī –∑–į –Ņ–ĺ–Ľ—É—á–į–≤–į–Ĺ–Ķ –Ĺ–į —á–Ķ—Ä–≤–Ķ–Ĺ–ĺ –Ĺ–į–ī 1000 –≥–ĺ–ī–ł–Ĺ–ł. –ó–į —Ā—ä–∂–į–Ľ–Ķ–Ĺ–ł–Ķ, –Ķ —Ā–ł–Ľ–Ĺ–ĺ —ā–ĺ–ļ—Ā–ł—á–Ķ–Ĺ.
–ú–ł–Ĺ–Ķ—Ä–į–Ľ—ä—ā –∂–ł–≤–į—á–Ķ–Ĺ —Ā—É–Ľ—Ą–ł–ī –Ķ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ä–Ķ–Ĺ –ł–∑—ā–ĺ—á–Ĺ–ł–ļ –∑–į —á–Ķ—Ä–≤–Ķ–Ĺ–ĺ-–ĺ—Ä–į–Ĺ–∂–Ķ–≤–ĺ. –í—Ā—ä—Č–Ĺ–ĺ—Ā—ā —ā–Ķ—Ä–ľ–ł–Ĺ–ł—ā–Ķ "—Ü–ł–Ĺ–ĺ–Ī—ä—Ä" –ł "—Ź—Ä–ļ–ĺ—á–Ķ—Ä–≤–Ķ–Ĺ–ĺ" —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į—ā –ļ–į—ā–ĺ —Ā–ł–Ĺ–ĺ–Ĺ–ł–ľ–ł –ł —Ā–Ķ –Ņ—Ä–ł–Ľ–į–≥–į—ā –ļ–į–ļ—ā–ĺ –ļ—ä–ľ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ–ł—ā–Ķ —ā–į–ļ–į –ł –∑–į –Ņ–ĺ-–ļ—ä—Ā–Ĺ–ĺ —Ā–ł–Ĺ—ā–Ķ–∑–ł—Ä–į–Ĺ–į—ā–į –Ī–ĺ—Ź –ĺ–ļ–ĺ–Ľ–ĺ 17-—ā–ł –≤–Ķ–ļ. –Ē–ĺ –ļ—Ä–į—Ź –Ĺ–į 18-—ā–ł –≤–Ķ–ļ —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į —Ā–į–ľ–ĺ —Ā–ľ–Ľ—Ź–Ĺ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ –ľ–ł–Ĺ–Ķ—Ä–į–Ľ –ļ–į—ā–ĺ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ü–ł–Ĺ–ĺ–Ī—ä—Ä –Ķ –Ņ–ĺ—á—ā–ł –ł–∑—Ü—Ź–Ľ–ĺ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä–į–Ĺ–ĺ –ĺ—ā –ļ–ł—ā–į–Ļ—Ü–ł—ā–Ķ. –Ę–ĺ–∑–ł –ľ–ł–Ĺ–Ķ—Ä–į–Ľ –ĺ—Ā—ā–į–≤–į –Ĺ–į–Ļ-–ī–ĺ–Ī—Ä–ł—Ź—ā –ľ–Ķ—ā–ĺ–ī –∑–į –Ņ–ĺ–Ľ—É—á–į–≤–į–Ĺ–Ķ –Ĺ–į —á–Ķ—Ä–≤–Ķ–Ĺ–ĺ –Ĺ–į–ī 1000 –≥–ĺ–ī–ł–Ĺ–ł. –ó–į —Ā—ä–∂–į–Ľ–Ķ–Ĺ–ł–Ķ, –Ķ —Ā–ł–Ľ–Ĺ–ĺ —ā–ĺ–ļ—Ā–ł—á–Ķ–Ĺ.
–ö–ĺ–Ī–į–Ľ—ā–ĺ–≤–ł—ā–Ķ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł –Ņ—ä—Ä–≤–ĺ–Ĺ–į—á–į–Ľ–Ĺ–ĺ —Ā–į –ī–ĺ–Ī–ł–≤–į–Ĺ–ł –ĺ—ā –ľ–ł–Ĺ–ł –≤ –Ď–ĺ—Ö–Ķ–ľ–ł—Ź. –Ę–Ķ —Ā–į –Ĺ–į—Ä–Ķ—á–Ķ–Ĺ–ł –ļ–ĺ–Ī–į–Ľ—ā–ł –Ņ–ĺ –ł–ľ–Ķ—ā–ĺ "kobolds" - –ľ–Ķ—Ā—ā–Ĺ–ł¬†–ī—É—Ö–ĺ–≤–Ķ –ł–Ľ–ł –Ņ—Ä–ł–∑—Ä–į—Ü–ł, –ļ–ĺ–ł—ā–ĺ –ľ–ł–Ĺ—Ć–ĺ—Ä–ł—ā–Ķ –≤—Ź—Ä–≤–į–Ľ–ł, —á–Ķ –ĺ–Ī–ł—ā–į–≤–į—ā –Ď–ĺ—Ö–Ķ–ľ–ł—Ź. –ü–ł–≥–ľ–Ķ–Ĺ—ā—ä—ā –ļ–ĺ–Ī–į–Ľ—ā–ĺ–≤–ĺ —Ā–ł–Ĺ—Ć–ĺ –Ī–ł–Ľ —Ā–ļ—ä–Ņ, –Ĺ–ĺ –ł–ľ–į–Ľ –ľ–Ĺ–ĺ–≥–ĺ —Ā—ā–į–Ī–ł–Ľ–Ķ–Ĺ —á–ł—Ā—ā–ĺ —Ā–ł–Ĺ —Ü–≤—Ź—ā- —ą–ł—Ä–ĺ–ļ–ĺ –Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ĺ –≤¬†–į–ļ–≤–į—Ä–Ķ–Ľ–ł –ł –Ķ –ī–ĺ–Ī—ä—Ä –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ –Ĺ–į —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ–ĺ–≤–ĺ—ā–ĺ —Ā–ł–Ĺ—Ć–ĺ.
 –°–ľ–į—Ä–į–≥–ī–ĺ–≤–ĺ—ā–ĺ –∑–Ķ–Ľ–Ķ–Ŗ嬆–Ķ¬†–ļ—Ä–į—Ā–ł–≤, –Ĺ–ĺ —Ā—ä—Č–ĺ –ĺ—ā—Ä–ĺ–≤–Ķ–Ĺ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā, –Ņ—Ä–Ķ–ī–Ľ–į–≥–į–Ĺ –Ĺ–į –Ņ–į–∑–į—Ä–į –Ņ–ĺ–ī –ł–ľ–Ķ—ā–ĺ –ü–į—Ä–ł–∂–ļ–ĺ –∑–Ķ–Ľ–Ķ–Ĺ–ĺ –ļ–į—ā–ĺ –ĺ—ā—Ä–ĺ–≤–į –∑–į –Ņ–Ľ—ä—Ö–ĺ–≤–Ķ. –ö–į—ā–ĺ –Ī–į–≥—Ä–ł–Ľ–ĺ –Ķ —Ā–ļ–Ľ–ĺ–Ĺ–Ķ–Ĺ –ī–į –ł–∑–Ī–Ľ–Ķ–ī–Ĺ—Ź–≤–į –Ĺ–į —Ā–Ľ—ä–Ĺ—á–Ķ–≤–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į (–Ķ—Ą–Ķ–ļ—ā, –ļ–ĺ–Ļ—ā–ĺ –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –Ĺ–į–ľ–į–Ľ–Ķ–Ĺ –≤ –ľ–į—Ā–Ľ–Ķ–Ĺ–ł—ā–Ķ –ļ–į—Ä—ā–ł–Ĺ–ł —á—Ä–Ķ–∑ –ł–∑–ĺ–Ľ–ł—Ä–į–Ĺ–Ķ –Ĺ–į –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–į –≤ –ľ–Ķ–∂–ī—É —Ā–Ľ–ĺ–Ķ–≤–Ķ –Ľ–į–ļ) –ł —Ā—ä—Č–ĺ –ł —Ä–Ķ–į–≥–ł—Ä–į —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł —Ā –ī—Ä—É–≥–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ. –Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä –Ĺ–Ķ –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –ļ–ĺ–ľ–Ī–ł–Ĺ–ł—Ä–į —Ā—ä—Ā ¬†—Ā—ä–ī—ä—Ä–∂–į—Č–ł —Ā—Ź—Ä–į –Ī–ĺ–ł –ļ–į—ā–ĺ –ļ–į–ī–ľ–ł–Ķ–≤–ĺ –∂—ä–Ľ—ā–ĺ, –į–Ľ–Ķ–Ĺ–ĺ –ł–Ľ–ł —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ–ĺ–≤–ĺ —Ā–ł–Ĺ—Ć–ĺ, –∑–į—Č–ĺ—ā–ĺ —Ä–Ķ–∑—É–Ľ—ā–į—ā—ä—ā —Č–Ķ –Ī—ä–ī–Ķ —ā—ä–ľ–Ĺ–ĺ–ļ–į—Ą—Ź–≤ —Ü–≤—Ź—ā. –í—ä–Ņ—Ä–Ķ–ļ–ł —ā–ĺ–≤–į, —ā–ĺ–Ļ¬†–Ķ¬†–Ľ—é–Ī–ł–ľ–į—ā–į –Ī–ĺ—Ź –Ĺ–į –Ņ–ĺ—Ā—ā–ł–ľ–Ņ—Ä–Ķ—Ā–ł–ĺ–Ĺ–ł—Ā—ā–į –ü–ĺ–Ľ –°–Ķ–∑–į–Ĺ. –í–į–Ĺ –ď–ĺ–≥ –Ķ –ī—Ä—É–≥ –∑–į–Ņ–į–Ľ–Ķ–Ĺ –Ĺ–Ķ–≥–ĺ–≤ –Ņ–ĺ—ā—Ä–Ķ–Ī–ł—ā–Ķ–Ľ.¬†
–°–ľ–į—Ä–į–≥–ī–ĺ–≤–ĺ—ā–ĺ –∑–Ķ–Ľ–Ķ–Ŗ嬆–Ķ¬†–ļ—Ä–į—Ā–ł–≤, –Ĺ–ĺ —Ā—ä—Č–ĺ –ĺ—ā—Ä–ĺ–≤–Ķ–Ĺ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā, –Ņ—Ä–Ķ–ī–Ľ–į–≥–į–Ĺ –Ĺ–į –Ņ–į–∑–į—Ä–į –Ņ–ĺ–ī –ł–ľ–Ķ—ā–ĺ –ü–į—Ä–ł–∂–ļ–ĺ –∑–Ķ–Ľ–Ķ–Ĺ–ĺ –ļ–į—ā–ĺ –ĺ—ā—Ä–ĺ–≤–į –∑–į –Ņ–Ľ—ä—Ö–ĺ–≤–Ķ. –ö–į—ā–ĺ –Ī–į–≥—Ä–ł–Ľ–ĺ –Ķ —Ā–ļ–Ľ–ĺ–Ĺ–Ķ–Ĺ –ī–į –ł–∑–Ī–Ľ–Ķ–ī–Ĺ—Ź–≤–į –Ĺ–į —Ā–Ľ—ä–Ĺ—á–Ķ–≤–į —Ā–≤–Ķ—ā–Ľ–ł–Ĺ–į (–Ķ—Ą–Ķ–ļ—ā, –ļ–ĺ–Ļ—ā–ĺ –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –Ĺ–į–ľ–į–Ľ–Ķ–Ĺ –≤ –ľ–į—Ā–Ľ–Ķ–Ĺ–ł—ā–Ķ –ļ–į—Ä—ā–ł–Ĺ–ł —á—Ä–Ķ–∑ –ł–∑–ĺ–Ľ–ł—Ä–į–Ĺ–Ķ –Ĺ–į –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–į –≤ –ľ–Ķ–∂–ī—É —Ā–Ľ–ĺ–Ķ–≤–Ķ –Ľ–į–ļ) –ł —Ā—ä—Č–ĺ –ł —Ä–Ķ–į–≥–ł—Ä–į —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł —Ā –ī—Ä—É–≥–ł —Ü–≤–Ķ—ā–ĺ–≤–Ķ. –Ě–į–Ņ—Ä–ł–ľ–Ķ—Ä –Ĺ–Ķ –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –ļ–ĺ–ľ–Ī–ł–Ĺ–ł—Ä–į —Ā—ä—Ā ¬†—Ā—ä–ī—ä—Ä–∂–į—Č–ł —Ā—Ź—Ä–į –Ī–ĺ–ł –ļ–į—ā–ĺ –ļ–į–ī–ľ–ł–Ķ–≤–ĺ –∂—ä–Ľ—ā–ĺ, –į–Ľ–Ķ–Ĺ–ĺ –ł–Ľ–ł —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ–ĺ–≤–ĺ —Ā–ł–Ĺ—Ć–ĺ, –∑–į—Č–ĺ—ā–ĺ —Ä–Ķ–∑—É–Ľ—ā–į—ā—ä—ā —Č–Ķ –Ī—ä–ī–Ķ —ā—ä–ľ–Ĺ–ĺ–ļ–į—Ą—Ź–≤ —Ü–≤—Ź—ā. –í—ä–Ņ—Ä–Ķ–ļ–ł —ā–ĺ–≤–į, —ā–ĺ–Ļ¬†–Ķ¬†–Ľ—é–Ī–ł–ľ–į—ā–į –Ī–ĺ—Ź –Ĺ–į –Ņ–ĺ—Ā—ā–ł–ľ–Ņ—Ä–Ķ—Ā–ł–ĺ–Ĺ–ł—Ā—ā–į –ü–ĺ–Ľ –°–Ķ–∑–į–Ĺ. –í–į–Ĺ –ď–ĺ–≥ –Ķ –ī—Ä—É–≥ –∑–į–Ņ–į–Ľ–Ķ–Ĺ –Ĺ–Ķ–≥–ĺ–≤ –Ņ–ĺ—ā—Ä–Ķ–Ī–ł—ā–Ķ–Ľ.¬†
–ź–∑—É—Ä–ł—ā—ä—ā –Ķ –∑–Ķ–Ľ–Ķ–Ĺ–ł–ļ–į–≤–ĺ —Ā–ł–Ĺ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā –ļ—Ä—ä—Ā—ā–Ķ–Ĺ –Ĺ–į –Ņ–Ķ—Ä—Ā–ł–Ļ—Ā–ļ–į—ā–į –ī—É–ľ–į "lazhward", –ļ–ĺ—Ź—ā–ĺ –ĺ–∑–Ĺ–į—á–į–≤–į "—Ā–ł–Ĺ—Ć–ĺ", —ā–ĺ–Ļ –Ķ —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł –Ī–Ľ–ł–∑–ĺ –ī–ĺ –∑–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ –ľ–į–Ľ–į—Ö–ł—ā. –ź–∑—É—Ä–ł—ā—ä—ā –Ķ –ł–∑–≤–Ķ—Ā—ā–Ķ–Ĺ –ĺ—Č–Ķ –ĺ—ā –ī—Ä–Ķ–≤–Ĺ–ĺ—Ā—ā—ā–į –ł —Ā—ā–į–≤–į –ł–∑–ļ–Ľ—é—á–ł—ā–Ķ–Ľ–Ĺ–ĺ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ä–Ķ–Ĺ –≤ –Ķ–Ņ–ĺ—Ö–į—ā–į –Ĺ–į –°—Ä–Ķ–ī–Ĺ–ĺ–≤–Ķ–ļ–ĺ–≤–ł–Ķ—ā–ĺ –ł –†–Ķ–Ĺ–Ķ—Ā–į–Ĺ—Ā–į, –ļ–į—ā–ĺ –Ķ–≥–ł–Ņ–Ķ—ā—Ā–ļ–ĺ —Ā–ł–Ĺ—Ć–ĺ. –ė–∑–Ņ–ĺ–Ľ–∑–≤–į —Ā–Ķ –≤ –ľ–į—Ā–Ľ–Ķ–Ĺ–į—ā–į –∂–ł–≤–ĺ–Ņ–ł—Ā. –ó–į–ľ–Ķ–Ĺ–Ķ–Ĺ –Ķ –ĺ—ā –Ņ—Ä—É—Ā–ļ–ĺ —Ā–ł–Ĺ—Ć–ĺ—ā–ĺ –≤ –Ĺ–į—á–į–Ľ–ĺ—ā–ĺ –Ĺ–į 18 –≤–Ķ–ļ, —Ā—ä–≤—Ā–Ķ–ľ –ł–∑–ĺ—Ā—ā–į–≤–Ķ–Ĺ —Ā–Ľ–Ķ–ī —Ā–ł–Ĺ—ā–Ķ–∑–ł—Ä–į–Ĺ–Ķ—ā–ĺ –Ĺ–į —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ–į –ł –ļ–ĺ–Ī–į–Ľ—ā–ĺ–≤–ĺ—ā–ĺ —Ā–ł–Ĺ—Ć–ĺ.
–í –ľ–ł–Ĺ–į–Ľ–ĺ—ā–ĺ —Ā–į —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ľ–ł —ą–ł—Ä–ĺ–ļ–į –≥–į–ľ–į –ĺ—ā –ĺ–Ľ–ĺ–≤–Ĺ–ł –ļ–į—Ä–Ī–ĺ–Ĺ–į—ā–ł –∑–į –Ī–Ķ–Ľ–ł –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł, —Ā—ä—Č–ĺ –ĺ—ā—Ä–ĺ–≤–Ĺ–ł.¬†

 –ě–Ī—ä—Ä–Ĺ–Ķ—ā–Ķ –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į —Ä–į–∑–Ľ–ł—á–Ĺ–ł—ā–Ķ –≤–Ķ—Ä—Ā–ł–ł –Ĺ–į –ļ–į—Ä—ā–ł–Ĺ–į –Ĺ–į¬†–ú–į—ā–ł—Ā.¬†–ē–ī–Ĺ–į—ā–į –Ķ –Ī–ĺ—Ź–ī–ł—Ā–į–Ĺ–į —Ā –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–į –Ņ–į–Ľ–ł—ā—Ä–į –ĺ—ā –ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł (–≤–Ľ—Ź–≤–ĺ), –į –ī—Ä—É–≥–į—ā–į - —Ā –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į (–≤–ī—Ź—Ā–Ĺ–ĺ).
–ě–Ī—ä—Ä–Ĺ–Ķ—ā–Ķ –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į —Ä–į–∑–Ľ–ł—á–Ĺ–ł—ā–Ķ –≤–Ķ—Ä—Ā–ł–ł –Ĺ–į –ļ–į—Ä—ā–ł–Ĺ–į –Ĺ–į¬†–ú–į—ā–ł—Ā.¬†–ē–ī–Ĺ–į—ā–į –Ķ –Ī–ĺ—Ź–ī–ł—Ā–į–Ĺ–į —Ā –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–į –Ņ–į–Ľ–ł—ā—Ä–į –ĺ—ā –ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł (–≤–Ľ—Ź–≤–ĺ), –į –ī—Ä—É–≥–į—ā–į - —Ā –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ĺ–ł –Ī–į–≥—Ä–ł–Ľ–į (–≤–ī—Ź—Ā–Ĺ–ĺ).
–ě—ā –ļ—Ä–į—Ź –Ĺ–į 19-—ā–ł –≤–Ķ–ļ, –Ņ–ĺ-–≥–ĺ–Ľ—Ź–ľ–į—ā–į —á–į—Ā—ā –ĺ—ā –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł, –ł–∑–Ņ–ĺ–Ľ–∑–≤–į–Ĺ–ł –ĺ—ā —Ö—É–ī–ĺ–∂–Ĺ–ł—Ü–ł—ā–Ķ —Ā–į –∑–į–ľ–Ķ–Ĺ–Ķ–Ĺ–ł –ĺ—ā —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ĺ–ł –≤–į—Ä–ł–į–Ĺ—ā–ł –Ĺ–į —Ā—ā–į—Ä–ł—ā–Ķ –Ī–ĺ–ł. –í –ī–Ĺ–Ķ—ą–Ĺ–ĺ –≤—Ä–Ķ–ľ–Ķ –Ņ–ĺ–≤–Ķ—á–Ķ—ā–ĺ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–ł –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ–ł —Ā–į –ĺ—Ā—ā–į—Ä–Ķ–Ľ–ł, –ł–∑–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ –Ķ –Ĺ–į–Ļ-—Ā–ļ—ä–Ņ–ł—ā–Ķ –ļ–į—ā–ĺ —É–Ľ—ā—Ä–į–ľ–į—Ä–ł–Ĺ, –ł–∑—Ä–į–Ī–ĺ—ā–Ķ–Ĺ –ĺ—ā –Ī–Ľ–į–≥–ĺ—Ä–ĺ–ī–Ĺ–ł—Ź –Ľ–į–Ņ–ł—Ā –Ľ–į–∑—É—Ä–ł—ā. –°—ä–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ł—ā–Ķ –ł–∑–ļ—É—Ā—ā–≤–Ķ–Ĺ–ł –ĺ—Ü–≤–Ķ—ā–ł—ā–Ķ–Ľ–ł —Ā–į –Ņ–ĺ-—ā—Ä–į–Ļ–Ĺ–ł, –Ņ–ĺ-—Ź—Ä–ļ–ł –ł –∑–Ĺ–į—á–ł—ā–Ķ–Ľ–Ĺ–ĺ –Ņ–ĺ-–Ķ–≤—ā–ł–Ĺ–ł –ł –Ņ–ĺ-–Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ł –∑–į –Ņ–ĺ–Ľ–∑–≤–į–Ĺ–Ķ.
–£–ī–ł–≤–ł—ā–Ķ–Ľ–Ĺ–ĺ –Ķ –ļ–ĺ–Ľ–ļ–ĺ –ľ–Ĺ–ĺ–≥–ĺ –ĺ—ā –Ņ–ĺ-—Ā—ā–į—Ä–ł—ā–Ķ –Ņ–ł–≥–ľ–Ķ–Ĺ—ā–ł —Ā–į –Ī–ł–Ľ–ł —Ā–ł–Ľ–Ĺ–ĺ —ā–ĺ–ļ—Ā–ł—á–Ĺ–ł —Ā—ä–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź, —Ā—ä–ī—ä—Ä–∂–į—Č–ł –ĺ–Ľ–ĺ–≤–ĺ, –∂–ł–≤–į–ļ, —Ö—Ä–ĺ–ľ, –į—Ä—Ā–Ķ–Ĺ - –ī–ĺ—Ä–ł —Ü–ł–į–Ĺ–ł–ī. –ö–į—ā–ĺ —Ā–Ķ –∑–Ĺ–į–Ķ –ļ–ĺ–Ľ–ļ–ĺ –ĺ—ā–ī–į–ī–Ķ–Ĺ–ł –ļ—ä–ľ —Ä–į–Ī–ĺ—ā–į—ā–į —Ā–ł —Ā–į –Ī–ł–Ľ–ł –ľ–Ĺ–ĺ–≥–ĺ –ĺ—ā —Ā—ā–į—Ä–ł—ā–Ķ –ľ–į–Ļ—Ā—ā–ĺ—Ä–ł, –ľ–ĺ–∂–Ķ —Ā–į–ľ–ĺ –ī–į —Ā–Ķ —É—á—É–ī–≤–į–ľ–Ķ –ļ–į–ļ —Ā–į –ĺ—Ü–Ķ–Ľ—Ź–≤–į–Ľ–ł –Ņ—Ä–ł –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ–ł—Ź —Ā–ł –ļ–ĺ–Ĺ—ā–į–ļ—ā —Ā –ĺ—ā—Ä–ĺ–≤–Ĺ–ł—ā–Ķ —Ö–ł–ľ–ł–ļ–į–Ľ–ł. –Ě–ĺ, –ļ–į–ļ—ā–ĺ —Ā–Ķ –ļ–į–∑–≤–į - –ł–∑–ļ—É—Ā—ā–≤–ĺ—ā–ĺ –ł—Ā–ļ–į –∂–Ķ—Ä—ā–≤–ł.
–ė–∑—ā–ĺ—á–Ĺ–ł—Ü–ł:
Colour me chemical, Theodore Gray
–ü–ĺ—á–Ķ–ľ—É –≤—Ā—Ď –≤–ĺ–ļ—Ä—É–≥ —ā–į–ļ–ĺ–Ķ, –ļ–į–ļ–ĺ–Ķ –ĺ–Ĺ–ĺ –Ķ—Ā—ā—Ć?,¬†–Ď–Ķ–Ľ–Ľ—É—Ä –°–ł–≤–į—Ä–į–ľ–ł—Ź –ß–į–Ĺ–ī—Ä–į—Ā–Ķ–ļ–į—Ä
What are Earth and Mineral Pigments?




















–ö–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł
–ú–ĺ–Ľ—Ź, —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–į–Ļ—ā–Ķ —Ā–Ķ –ĺ—ā T–£–ö!
–ź–ļ–ĺ –≤–Ķ—á–Ķ –ł–ľ–į—ā–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł—Ź, –Ĺ–į—ā–ł—Ā–Ĺ–Ķ—ā–Ķ –Ę–£–ö!
–Ě—Ź–ľ–į –ļ–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł –ļ—ä–ľ —ā–į–∑–ł –Ĺ–ĺ–≤–ł–Ĺ–į !
–ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł –ļ–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł
Johnny B Goode
–ü—Ä–Ķ—Ā—ā–ł–∂–Ĺ–į –Ĺ–į–≥—Ä–į–ī–į –ĺ—ā –Ď–ź–Ě —Ā–Ņ–Ķ—á–Ķ–Ľ–ł –≥–Ľ–į–≤–Ĺ–ł—Ź—ā —Ä–Ķ–ī–į–ļ—ā–ĺ—Ä –Ĺ–į –Ě–į—É–ļ–įOFFNews
Gunteer
–ü—Ä–Ķ—Ā—ā–ł–∂–Ĺ–į –Ĺ–į–≥—Ä–į–ī–į –ĺ—ā –Ď–ź–Ě —Ā–Ņ–Ķ—á–Ķ–Ľ–ł –≥–Ľ–į–≤–Ĺ–ł—Ź—ā —Ä–Ķ–ī–į–ļ—ā–ĺ—Ä –Ĺ–į –Ě–į—É–ļ–įOFFNews
–•—Ä–ł—Ā—ā–ł—Ź–Ĺ–ł–Ĺ
–Ę–ĺ–≤–į –Ķ –ļ—Ä–į–Ľ—Ź—ā –Ĺ–į —ā–ł–ļ–≤–ł—ā–Ķ: –Ę–ł–ļ–≤–į—ā–į –ľ—É —ā–Ķ–∂–ł –Ĺ–į–ī –Ķ–ī–ł–Ĺ –Ķ–ī–ł–Ĺ —ā–ĺ–Ĺ
dolivo
–°–į—Ö–į—Ä–į –ĺ—á–į–ļ–≤–į 75% —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ĺ–į –≤–į–Ľ–Ķ–∂–ł—ā–Ķ –ī–ĺ 2100 –≥.