
Как загубата на епигенетична информация води до остаряване
С възрастта всички живи организми започват да губят генетична и епигенетична информация и с това не функционират пълноценно. И при тях, на клетъчно ниво, действа вездесъщият закон за нарастване на ентропията.
Основен фактор за остаряването е загубата на способността за поправка на нарушения в организацията на хроматина при двуверижни скъсвания на ДНК. В януарския брой на списанието Cell, голям международен тим учени представят резултатите от опити със специално модифицирана мишка, в която могат контролируемо да се предизвикват промени в епигенома - ICE - inducible changes in the epigenome.
Ако генетичната информация е записана в ДНК последователностите на генома, управлението на тази информация е заложено в епигенома. Той е носител на над-генетична информация за ДНК - метилирането, модификация на хистоните, ремоделирането на хроматина, регулацията чрез некодиращи РНК, РНК-модикациите и др.
 Фиг.2 Съвкупността от тези над-геномни характеристики оформя епигенетичния профил (landscape). Този профил се променя със остаряването. Клетките загубват възможността да поправят двуверижните скъсвания на двойната спирала ДНК (DSB). Като следствие хроматинът се реорганизира. Епигенетичният профил се изражда. Загубва се епигенетичната информация. Остаряващият епигеном е представен на фигурата без добре оформени долчинки в епигенетичния профил . В младия епигеном метафоричните долчинки са топологично свързани домени на хроматина(TAD) , в които могат да стават важни взаимодействия. Тези домени се “размазват” със възрастта - ентропията на епигенома се увеличава. Клетъчната идентичност и функция се променят. Остаряването разваля машинарията за поправка на скъсвания в ДНК, които зачестяват с възрастта. Хистоновите модификации и локализацията на хроматиновите фактори в хроматина се променят. Това завъртва епигенетичния часовник - опитната мишка отслабва, космите посивяват и оредяват. За щастие, епигеномът може да бъде манипулиран с подмладяващи агенти - това са откритите от нобеловия лауреат Яманака и сътр. фактори - OSK (гените Oct4,Sox2, иKlf4) Кредит: Yang et al., 2023, Cell 186, 305–326 January 19, 2023 ª 2022 Elsevier Inc. https://doi.org/10.1016/j.cell.2022.12.027
Фиг.2 Съвкупността от тези над-геномни характеристики оформя епигенетичния профил (landscape). Този профил се променя със остаряването. Клетките загубват възможността да поправят двуверижните скъсвания на двойната спирала ДНК (DSB). Като следствие хроматинът се реорганизира. Епигенетичният профил се изражда. Загубва се епигенетичната информация. Остаряващият епигеном е представен на фигурата без добре оформени долчинки в епигенетичния профил . В младия епигеном метафоричните долчинки са топологично свързани домени на хроматина(TAD) , в които могат да стават важни взаимодействия. Тези домени се “размазват” със възрастта - ентропията на епигенома се увеличава. Клетъчната идентичност и функция се променят. Остаряването разваля машинарията за поправка на скъсвания в ДНК, които зачестяват с възрастта. Хистоновите модификации и локализацията на хроматиновите фактори в хроматина се променят. Това завъртва епигенетичния часовник - опитната мишка отслабва, космите посивяват и оредяват. За щастие, епигеномът може да бъде манипулиран с подмладяващи агенти - това са откритите от нобеловия лауреат Яманака и сътр. фактори - OSK (гените Oct4,Sox2, иKlf4) Кредит: Yang et al., 2023, Cell 186, 305–326 January 19, 2023 ª 2022 Elsevier Inc. https://doi.org/10.1016/j.cell.2022.12.027

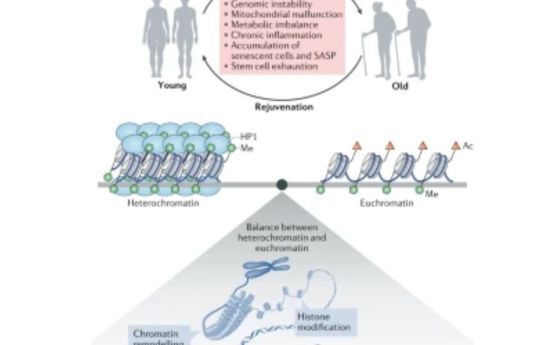
Фиг. 3 Промени във структурата на хроматина при стареене (ремоделиране): загубва се хетерохроматиновата опаковка на асоциираните с ламини домени (LAD). Те се откачват от ядрената ламина, хроматинът се разгъва , става достъпен за модифициращи фактори, което води до преразпределение на метилираните хистони (H3K4me3, H3K27me3, H3K36me3, H3K9me3) и на ацетилираните хистони (H3K9ac, H3K56ac, H4K16ac, H3K18ac). Тази променена достъпност на хроматина разрегулира генната експресия. Гени, дотогава неактивни, започват да работят, а други, които трябва да работят, замлъкват. Кредит: обзор (2) на Wang, K., Liu, H., Hu, Q. et al. Epigenetic regulation of aging: implications for interventions of aging and diseases. Sig Transduct Target Ther 7, 374 (2022). https://doi.org/10.1038/s41392-022-01211-8
Проф. Давид Синклер (David Sinclair), основен автор на статията (3) в списанието Cell, обяснява как промени в организацията и регулацията на ДНК ускорява стареенето:
“Вярваме, че нашето изследване е първото, което показва епигенетичните промени като основен двигател на стареенето при бозайници“.
Обширната поредица от експерименти на екипа дава дългоочаквано потвърждение, че промените (мутации) в ДНК не са единствената, нито основната причина за стареенето. Резултатите показват, че химическите и структурни промени в хроматина - комплексът от ДНК и протеини, предизвикват стареенето.
Авторите отбелязват, че тъй като е по-лесно да се манипулират молекулите, които контролират епигенетичните процеси, отколкото да се поправят мутациите на ДНК, то ще е по-лесно да се намерят нови пътища за предотвратяване или лечение на свързани с възрастта увреждания.
„Надяваме се, че тези резултати са повратна точка в способността ни да контролираме стареенето“, заявява Синклер. „Това е първото проучване, което показва, че можем да имаме прецизен контрол върху биологичната възраст на едно сложно животно; че можем да го караме напред и назад във времето по желание."
Хистоните свързват ДНК в плътно уплътнен хроматин. Гените са недостъпни, когато са групирани в такава структура, но са достъпни за копиране и използване за производство на протеини, когато не са навити плътно, а разгънати.
Епигенетичните фактори регулират кои гени са активни или неактивни във всяка дадена клетка във всеки даден момент. Като действат като превключвател за генната активност, тези епигенетични молекули помагат да се определи клетъчният тип и функция.
Тъй като всяка клетка в един организъм има основно една и съща ДНК, превключването между отделни гени е това, което разграничава нервната клетка от мускулната клетка от белодробната клетка.
Епигенетиката е като операционната система на клетката, която й казва как да използва същия генетичен материал по различен начин. Остаряването е проблем на клетъчния “софтуер”.
Клетките на бозайниците изпитват всеки ден 10-50 скъсвания (на клетка, на ден) на ДНК в отговор на неща като дишане, излагане на слънчева светлина и космически лъчи и контакт с определени химикали.
За да проверят дали стареенето е резултат от този процес, изследователите ускоряват броя на двуверижни скъсвания на ДНК (DSB - double strand breaks), за да симулират живота при бързо превъртане на “лентата” напред.
Екипът също така гарантира, че повечето от прекъсванията не са направени в кодиращите области на ДНК на мишките - сегментите, които изграждат гените. Това попречва на гените на животните да развият мутации.
Прекъсванията променят начина, по който се сгъва ДНК. Синклер и колегите наричат своята система ICE, съкращение от индуцируеми промени в епигенома. За скъсване се използва специална ендонуклеаза I-Ppol, която разпознава специфична ДНК последователност от 15 нуклеотида, и се срещат на 20 места в мишия геном. 19 от тях са в некодираща ДНК (вкл. и рибозомната рДНК), и нито една в митохондриалната ДНК.
Тази хирургическа генна ножица е обрамчена с ДНК последователности, които я правят функционална само когато се подаде тамоксифен. В резултат на тази индукция в ядрото се локализира ендонуклеазата. В отсъствие на тамоксифен тя се разгражда. Така инженираната трансгенна мишка се нарича ICE- (inducible changes in the epigenome) - индуцирани промени в епигенома.
Изследванията могат да се правят освен с мишки, и само с миши ембрионални фибробласти. Клетъчните анализи показват, че въвеждането на ограничени по брой скъсвания, не променят забележимо нито клетъчния цикъл, апоптозата, честотата на мутиране, нива на РНК, транслационна ефективност. 96 часа след спиране на тамоксифена, няма остатъчна активност на ендонукеасата I-Ppol.
По много параметри клетките от ICE-мишки изглеждат 1.5 пъти по-остарели от контролните, и то без увеличаване на честотата на мутациите. Мишките са подложени на ендонуклеазата за три седмици.
В около 70% от органите I-Ppol e активирана. След един месец започват леки изменения- опадане на космите, и пигмента по крайниците. На десетия месец след третирането ICE-мишките показват типични признаци на остаряване: отслабват, обездвижват се, мускулите, координирането, зрението и слухът им отслабва. След 10 месеца ICE-мишките приличат по остаряване на 24-месечни контролни мишки. Тaka, че ICE-мишките показват ускорено епигенетично остаряване, което се проявява в експресията на гените и свързаните с това модификации на хроматинови фактори.
Отначало епигенетичните фактори спират нормалната си работа по регулиране на гените и се преместват към скъсваниаята на ДНК, за да координират ремонтите. След това факторите се връщат първоначалните си места. Но с течение на времето нещата се променят. Изследователите забелязват, че епигенетичноте фактори се „разсейват“ и не се връщат у дома за почивка след ремонта. Епигеномът става дезорганизиран и започна да губи първоначалната си информация. Топологично свързаните домени (TAD) не се променят в ICE-мишките, но ДНК-белтъчните контакти се размазват, изолацията на регулаторните участъци се нарушава, а това се отразява на точната поправка на ДНК (вж. Фиг.2 по-горе)
Тъй като мишките загубват “младежката” си епигенетична функция, те започват да изглеждат и да се държат като стари.
Екипът на Синклър използва епигенетичен часовник (вж. "Три години по-млад само за осем седмици? Възможно е според ново проучване") за измерване на колко години са били мишките, не хронологично, в дни или месеци, а „биологично“, въз основа на това колко места в генома са загубили метиловите групи обикновено прикрепени към тях.
В сравнение с нетретираните контролните мишки, родени по същото време, ICE мишките са остарели значително повече. Остаряването на ICE-мишките, отчетено по епигенетичния часовник (метилиране на ДНК) е 50% по-бързо от контролните мишки.
Същият резултат се получава при експерименти с ембрионални фибробласти. Как епигенетични часовник минава напред вследствие на двуверижните скъсвания на ДНК (DSB), не е ясно. Една възможност е DSB да предизвиква релокализация на ензима ТЕТ(ten-eleven translocation enzyme) и на ДНК метилтрансферазите (DNMTs).
Като следваща стъпка изследователите подлагат ICE-мишките на генна терапия, която обръща епигенетичните промени, които причиняват стареенето.
„Това е като рестартиране на неправилно работещ компютър“, коментира Синклер. "Терапията доставя трио от гени - Oct4,Sox2, и Klf4, наречени заедно “OSK” - които са активни в стволовите клетки и могат да помогнат за връщането на зрелите клетки към по-ранно състояние. Органите и тъканите на мишките ICE възобновяват младостта си. Терапията „задейства” епигенетична програма, която кара клетките да възстановят епигенетичната информация, която са имали, когато са били млади“, разказва Синклер. „Това е постоянно нулиране.“
След пет седмици на индуцирана експресия на OSK нивата на маркерите за остаряване в бъбреците и мускулите са сходни с контролни млади органи. Как точно лечението с OSK постига това, остава неясно. На този етап, посочва Синклер, откритието подкрепя хипотезата, че клетките на бозайниците поддържат един вид резервно копие на епигенетичен софтуер, който когато бъде достъпен, може да позволи на възрастна, епигенетично кодирана клетка да се рестартира в “младо”, здраво състояние.
Тъй като признаците на стареене се развиват при мишките ICE само след шест месеца, а не към края на средната продължителност на живота на мишката от две години и половина, подходът също спестява време и пари на изследователите, изучаващи стареенето.
Изследователите могат също така да погледнат отвъд генната терапия с OSK, за да проучат как изгубената епигенетична информация може да бъде възстановена в старите организми. Синклер се надява работата да вдъхнови други учени да проучат как да контролират стареенето, за да предотвратят и премахнат свързаните с възрастта заболявания и състояния при хората, като сърдечно-съдови заболявания, диабет тип 2, невродегенерация и слабост.
„Всички това са прояви на стареене, които се опитваме да лекуваме с лекарства, когато се появят, и е вече твърде късно“, коментира Синклер.
Целта е, да се обърне внимание на основните причини за стареенето, за да се удължи продължителността на човешкото здраве: броят години, през които човек остава не просто жив, но и здрав.
Медицинските приложения са далече и ще изискват обширни експерименти в множество клетъчни и животински модели.
Но Синклер смята, че учените трябва да мислят мащабно и да продължават да се опитват, за да постигнат такива мечти:
„Говорим за това да вземем някой, който е стар или болен, и да направим цялото му тяло или определен орган отново млад, така че болестта да изчезне“.
Справка:
1.Zhang, W., Qu, J., Liu, GH. et al. The ageing epigenome and its rejuvenation. Nat Rev Mol Cell Biol 21, 137–150 (2020). https://doi.org/10.1038/s41580-019-0204-5
2.Wang, K., Liu, H., Hu, Q. et al. Epigenetic regulation of aging: implications for interventions of aging and diseases. Sig Transduct Target Ther 7, 374 (2022). https://doi.org/10.1038/s41392-022-01211-8
3. Yang et al., “ Loss of epigenetic information as a cause of mammalian aging” 2023, Cell 186, 305–326 January 19, 2023 ª 2022 Elsevier Inc. https://doi.org/10.1016/j.cell.2022.12.027
4. https://hms.harvard.edu/news/loss-epigenetic-information-can-drive-aging-restoration-can-reverse
Подбор и обсъждане - Константин К. Чипев, PhD в Ню-Йоркския Щатски У-тет в Стони Брук.



















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
4I4ATA
Нов, скрит досега вход в пирамидата на Микерин е открит по аномалии при сканиране
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews