
Швейцарската фармацевтична компания Novartis е подала молба за европейско одобрение до Европейската агенция по лекарствата (ЕМА) за своята клетъчна терапия Кимриа (Kymriah) за две форми на рак на кръвта, съобщи Ройтерс.
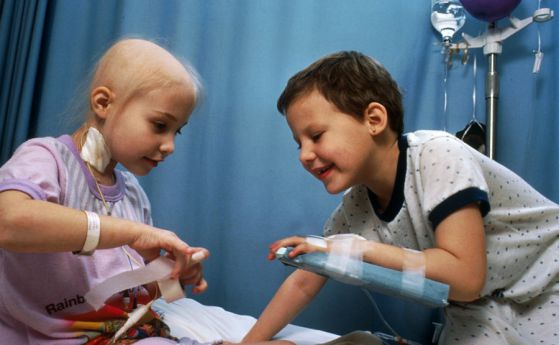
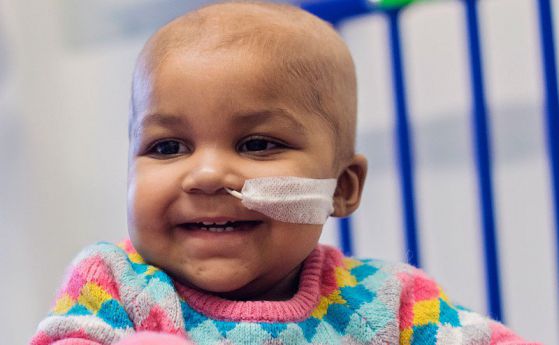
Кимриа ще се прилага при деца и младежи с остра лимфобластна левкемия (ALL) и възрастни пациенти с дифузен В-клетъчен лимфом (DLBCL), които не отговарят на условията за трансплантация на стволови клетки, твърдят от компанията.
Терапията е одобрена в САЩ за ALL и бе подадено в най-големия пазар в света лекарство за възрастни с DLBCL миналата седмица.
Кимриа извлича имунни T-клетки от пациента и ги изпраща в лаборатория, където те са модифицирани така, че да включват нов ген, който ги насочва към определени ракови клетки. След това Т-клетките се връщат обратно в тялото на пациента.

„Кимриа е първото по рода си лечение, което запълва огромна празнина при терапията на деца и млади възрастни с това сериозно заболяване“, казва Питър Маркс, директор на Центъра по биологични оценки и изследвания на Федералната администрация по лекарствата. „Кимриа не само осигурява нова алтернатива за терапия, но дава окуражителна статистика за ремисия и преживяемост при клиничните тестове“.
Докато одобрението на Кимриа през август в САЩ отбеляза нова епоха в лечението на рака, лекарството има конкуренти за лечението на дифузен В-клетъчен лимфом (DLBCL). Миналия месец Американската администрация по храните и лекарствата одобри препарата Yescarta на американската фармацевтична компания Gilead.
"Представянето на Европейската агенция по лекарствата е важна стъпка към нашата цел терапията да достигне до повече пациенти с рак в критично състояние по целия свят", заяви Вас Нарасиман (Vas Narasimhan), главен разработчик на лекарствата на Novartis.
Novartis определя за Кимриа цена от 475 000 долара за лечение за по-млади пациенти, но компанията си запазва правото да прецизирв цената за.
Gilead продава препарата си Yescarta за 373 000 долара за пациент.















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
4I4ATA
Нов, скрит досега вход в пирамидата на Микерин е открит по аномалии при сканиране
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews