

Пространственото разделяне на активните от неактивните фракции на генома в клетъчното ядро е от изключително значение за контрола на генната експресия.
Ново проучване, публикувано в Nature с участието на гл. ас. Яна Феодорова от Медицинския университет в Пловдив, разкрива водещите до това разделяне механизми и преобръща наопаки представите ни за клетъчното ядро.
Еукариотните хромозоми са изградени от хроматин, комплект от ДНК и асоциирани протеини. В зависимост от транскрипционната активност и степента на компактизация могат да бъдат разграничени два типа хроматин, които са пространствено разделени в ядрото.
Силно кондензираната фракция се състои от хроматинови региони, които съдържат малък брой гени и са транскрипционно неактивни. Тя се означава като хетерохроматин и е разположена в периферията на ядрото в близост до ядрената мембрана. От друга страна, еухроматинът е богат на гени и представлява активната част от генома. Намира се във вътрешността на ядрото и е по-рехаво опакован, което го прави по-достъпен за протеиновите машини, необходими за генната експресия. Този основен модел на геномна организация се открива практически във всички еукариотни клетъчни типове, но механизмите, които водят до формирането му, все още не са достатъчно добре изяснени.
Според ново изследване движещата сила в разделянето на хроматина е неактивният хетерохроматин, а в „стандартно“ състояние позициите на еухроматина и хетерохроматина са разменени.
Новите открития са публикувани във водещия журнал Nature. Изследването е проведено от екип биолози, воден от д-р Ирина Соловей от Биоцентъра на „Лудвиг-Максимилианс-Университет“ в Мюнхен, в сътрудничество с проф. Йоб Деккер от Медицинския факултет на Масачузетския университет и физици от екипа на проф. Леонид Мирни в Масачузетския технологичен институт. Част от екипа биолози и един от тримата равностойно допринесли първи автори на статията в Nature е д-р Яна Феодорова от Медицински университет – Пловдив.
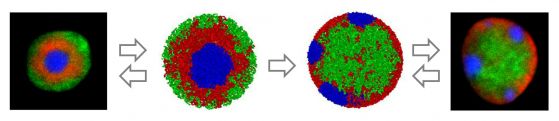 От ляво надясно: обърнато ядро на пръчица, полимерни модели на обърнати и конвенционални ядра, конвенционално ядро на друг ретинален неврон. Източник: Ирина Соловей и Леонид Мирни
От ляво надясно: обърнато ядро на пръчица, полимерни модели на обърнати и конвенционални ядра, конвенционално ядро на друг ретинален неврон. Източник: Ирина Соловей и Леонид Мирни
До момента са предлагани множество механизми, обясняващи как двата типа хроматин се разделят в клетъчното ядро, но нито един от тях не е достатъчно убедителен. Това се дължи на трудността при анализа на взаимодействията между двата типа хроматин в контекста на конвенционалните клетъчни ядра, в които хетерохроматинът е закотвен към клетъчната мембрана.
„По тази причина за нашето проучване избрахме да използваме т.нар. обърнати клетъчни ядра“, казва д-р Соловей.
Тя и нейните колеги откриват тези ядра преди 10 години в ретината на нощни бозайници, по-специално във фоторецепторните клетки, известни като пръчици.
В пръчиците силно кондензираният хетерохроматин е пакетиран във вътрешността на ядрото, докато активният еухроматин се локализира директно под ядрената мембрана: уникално изключение от основното правило. Оказва се, че хетерохроматиновaта сърцевина на ядрата на пръчиците служи като микролеща, която концентрира светлината и по този начин подобрява оптичните качества на нощните ретини. Последващо проучване на същия екип учени разкрива и механизма на обръщане, като доказа, че в тези атипични ядра липсват два протеинови комплекса, които свързват хетерохроматина към вътрешната повърхност на ядрената мембрана: ядрената ламина.
 Разрез през ретината. Пръчиците с обърнати ядра са в горната област на изображението, другите неврони на ретината с конвенционални ядра са по-долу. Снимка: И. Соловей
Разрез през ретината. Пръчиците с обърнати ядра са в горната област на изображението, другите неврони на ретината с конвенционални ядра са по-долу. Снимка: И. Соловей
За най-новото си изследване учените създават полимерни модели на единични хромозоми и цели ядра, като използват данни, получени чрез комбиниране на модерна микроскопия и молекулярно-биологични техники. Чрез симулиране на поведението на тези полимери при различни условия те успяват да изследват ролята на взаимодействията между двете фракции на хроматина и ядрената ламина. Тези проучвания показват, че само взаимодействията между хетерохроматинови региони са достатъчни за пространственото разделяне на хроматина, докато взаимодействията в еухроматина не са необходими за този процес.
„Нашите резултати показват, че обърнатото ядро концептуално представлява стандартната ядрена архитектура“, казва проф. Мирни, „докато взаимодействията между хетерохроматина и ядрената ламина са важни за построяването на конвенционалната архитектура“.
„Поради това“, допълва д-р Соловей, „е интересно да се запитаме защо повечето еукариоти имат конвенционални ядра, и каква би мога да е функционалната значимост на разположението на хетерохроматина в ядрената периферия“. „Все още съм запленена от обърнатите ядра на пръчиците, защото те са прекрасен пример за екстравагантните решения на природата“, казва д-р Феодорова.
„Интересно е, че в този случай първо отговорихме на въпроса защо ядрата на пръчиците имат обърната архитектура: подобрено зрение. След това научихме и как става това: липсващи хетерохроматинови „котви“ в ламината. Накрая ги използвахме като съвършен модел на симетрична компартментализация, за да докажем, че хетерохроматинът е архитектът на клетъчното ядро“, обобщава тя.
Публикация: Nature 2019, Heterochromatin drives compartmentalization of inverted and conventional nuclei
Martin Falk, Yana Feodorova, Natalia Naumova, Maxim Imakaev, Bryan R. Lajoie, Heinrich Leonhardt, Boris Joffe, Job Dekker, Geoffrey Fudenberg, Irina Solovei, Leonid A. Mirny
doi: 10.1038/s41586-019-1275-3
Още информация: Was den Zellkern im Innersten zusammenhält, „Лудвиг-Максимилианс-Университет“, Мюнхен

















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон
dolivo
Сахара очаква 75% увеличение на валежите до 2100 г.
dolivo
Земната ябълка: стара култура за новите климатични времена