
В квантовата механика е установено, че поведението на фермионите се подчинява на така наречения принцип на Паули (принцип на забраната), формулиран от австрийския физик Волфганг Паули (Wolfgang Pauli) през 1925 година, в процеса на работа върху квантовото тълкуване на ефекта на Зееман и впоследствие действието му е разпространено върху всички частици с полуцяло число спин.
Мистерията на стабилността
Един атом се състои от протони, неутрони и електрони. В началото на 20-ти век, химиците открили нещо странно: атоми с нечетен брой електрони са много по-слонни да се свързват с други атоми и молекули и да образуват атоми с четен брой електрони.
Електроните в един атом заемат определени специални "енергийни нива", всяко едно на различно разстояние от ядрото. Химиците решили, че може би броят на електроните във всяко ниво има нещо общо с това как влиза в реакции един атом. През 1919 г., Ървинг Лангмюр (Irving Langmuir) предположил, че всяко енергийно ниво може да съдържа най-много два електрона. Електроните "предпочитат" да бъдат в най-ниското възможно енергийно ниво - те дори може да отделят енергия под формата на фотон, за да гарантират това . Предложението на Лангмюр означава, че когато се добавят електрони, трябва да запълнят първо орбитите с ниска енергия. Всяка орбита получава само два електрона, за да се запълни, което принуждава електроните, които идват по-късно, да заемат все по-високи и по-високи енергийни нива.
Лангмюр твърди, че един атом е в най-изгодно (т.е. с най-ниска енергия) състояние, когато всички негови орбитали са запълнени. Това означава, че е най-външната орбитала трябва да има два електрона в себе си. Ако два атома имат наполовина пълни орбитали, то всеки може да сподели най-външния си електрон, за да се създаде обща орбитала, която е по-"изгодна" за атома. Този процес се нарича ковалентна връзка.
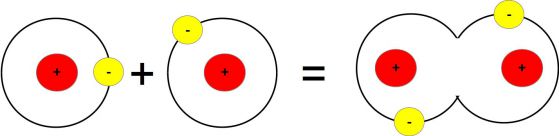 Схема: www.thephysicsmill.com
Схема: www.thephysicsmill.com
Но защо всяка орбитала е ограничена само до два електрона? Лангмюр не знаел отговора, а загадката била решена след още пет години.
Пълното обобщено доказателство на принципа е направено от Паули през 1940 г. в рамките на релативистката квантова механика и вълновата функция на система от фермиони
Принципът на Паули
Принципът на Паули може да бъде формулиран по следния начин:
два еднакви фермиона не може да заемат едно и също квантово състояние едновременно, те трябва да се различават най-малко с едно квантово число. Казано по друг начин: в едно и също пространство може да съществуват само една определена комбинация на материята.
Частиците с цяло число спин, наречени бозони, могат да бъдат елементарни частици, като фотони или глуони, но също така могат да бъдат съставни частици като мезони (кварк-антикварк двойки). Според статистическата квантова механика, те се подчиняват на статистика, която се нарича статистика на Бозе-Айнщайн.
За разлика от фермионите, бозоните не са предмет на принципа на Паули: два или повече бозони могат да заемат едно и също квантово състояние.
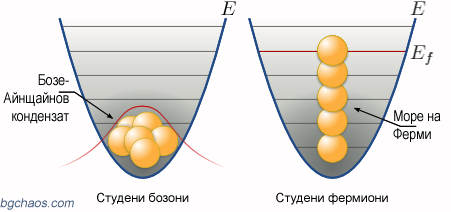
Представете си две проби, едната съдържа газ от бозони, а другата съдържа газ невзаимодействащи фермиони.
| Когато температурата спадне близо до абсолютната нула, газът от бозони се свива. В енергийния кладенец всички бозони могат да заемат едно и също ниско ниво на енергия, образувайки Бозе-Айнщайнов кондензат. Фермионите не могат да достигнат това състояние, тъй като две частици с еднакви квантови числа не могат да заемат едно и също ниво на енергията. |
 |
|
| Вероятно сте срещали и подобни на схемата вдясно илюстрации на принципа на Паули и сте си задавали въпроса: Защо електроните са по двойки? Защото електроните могат да имат две спинови състояния и затова на едно енергийно ниво може да има по два електрона - един с паралелен и един с антипаралелен спин. | 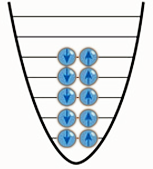 |
|
В случая общата енергия на газа от фермиони е по-голяма от сумата от енергиите на основните състояние на единичните частици. Енергията на най-високо заетото квантово състояние се нарича енергия нa Ферми.
Тези свойства определят фермионите като идеалният кандидат за "тухличките", които да изграждат материята, а бозоните - като идеалните кандидати, осъществяващи взаимодействията.
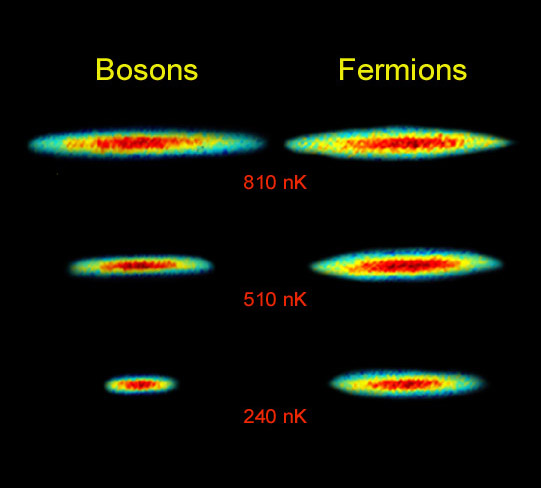 Илюстрация: Andrew G. Truscott и Randall G. Hulet, Университет RICE
Илюстрация: Andrew G. Truscott и Randall G. Hulet, Университет RICE
Принципът Паули демонстриран графично. На фигурата са показани облаци от два изотопа на лития. Левият облак се състои от бозони, а десния - от фермиони. Атомните облаци са показани в три различни температури: 810, 510 и 240 нано-Келвина. Един нано-Келвин е изключително ниска температура - една милиардна от градуса над абсолютната нула. Със снижаване на температурата бозоните се събират заедно, а фермионите остават на азстояние.
Строежът на атома и принципът на Паули
Атомите са съставени от ядро, съдържащо неутрони и протони, заобиколени с електрони. Електроните не се движат по определена траектория. Един електрон може да бъде във всяка част на околоядреното пространство, можем да говорим само за вероятност, възможност позицията му да е на определено разстояние от ядрото. Електронните орбитали са области в рамките на атома, където има най-голяма вероятност електроните да бъдат намерени. С други думи, в тях има висока електронна плътност. Пространство извън обхвата на орбиталите съответства на малка електронна плътност.
Принципът на Паули помага да си обясним различни физични явления. Следствие от принципа е съществуването на електронни обвивки в структурата на атома, от което пък следва разнообразието на химичните елементи и техните съединения.
Най-лесният начин да си представим в какво точно се състои принципа на Паули, ако сравним електроните с автомобили в многоетажен паркинг. Във всяка клетка се разполага само една кола, и когато всички клетки на долния етаж от паркинга са заети, автомобилът се качва на следващия етаж за да си намери свободна клетка. По същия начин електроните в атомите - всяка орбита около ядрото може да побере неповече, отколкото са "местата за паркиране", а след като всички места са заети в орбитата, следващия електрон търси място в по-висока орбита.
Стабилност на материята. Защо не се свиваме?
Всеки знае, че всички "твърди обекти" - камък, човек или звезда са практически празно пространство - "нищо". Защо тогава материята - ядрата и електроните не се свият до микроскопичен куп вместо да заемат този огромен неизползван обем? Причината е в принципа на Паули
Това предположение прави за първи път 1931 г. Пол Еренфест (Paul Ehrenfest), който забелязал, че електроните на всеки атом не могат да паднат на най-ниската енергийна орбитала, а трябва да заемат последователно по-високи обвивки. Атомите заемат обем и не може да бъде притиснати твърде натясно.
Доказателство за това е предоставено 1967 г. от Фрийман Дайсън и Андрю Ленард (Freeman Dyson and Andrew Lenard), които считат, че баланса на силите на привличане и отблъскване между електроните и ядрото показва, че обикновената материя ще се "срути" и ще заеме много по-малък обем без принципа на Паули.
Принципът на Паули е отговорен за това, че в нашия макроскопичeн свят два масивни обекти не могат да бъдат на едно и също място. Досега обаче не е ясно защо работи този принцип и какви са границите на неговото действие.
Принципът на Паули и астрофизиката. Еволюцията на звездите
Ще дойде време (след около 6,5 милиарда години), когато в недрата на Слънцето, ще свършат запасите от гориво за термоядрен синтез и силите на гравитационното привличане след 11 милиарда години борба ще победят. Слънцето бързо ще се свие, докато силите на гравитация не срещнат следващия, след победения вече термоядрен, защитен рубеж, който отново ще даде подобаващ отпор. За звезди от категорията на Слънцето такава бариера са свободните електрони в звездата. Електроните се подчиняват на принципа на Паули, според който на една орбита не може да има два електрона в еднакви състояния, тоест на всеки електрон му трябва "жизнено пространство" и електроните могат да се сближават до определен предел.
При гравитационен колапс звезда с маса близка до тази на Слънцето, се свива до размер, сравним с размерите на Земята, след което колапсът се прекратява противодействието на електроните, които няма накъде повече да се сближават. Такива звезди се наричат бели джуджета.
Бялото джудже не стига до пълен колапс благодарение на равновесието на две сили - гравитационното привличане и един вид налягане на електроните отвътре, причинено от принципа на Паули. В астрофизиката това налягане се нарича налягане на изроден електронен газ.
В началото на 30-те години на ХХ в. младият индийски физик Субрахманян Чандрасекар (Subrahmanyan Chandrasekhar), работейки над теорията за белите джуджета, формулирал важно следствие принцип на Паули, а именно: ако на масата на звезда превиши определен предел, равен на около 1,4 слънчеви маси, гравитационните сили ще се окажат по-силни от силите на налягането на изродения електронен газ и колапсът ще продължи. Тази маса от M = 1,4Mс получава името "граница на Чандрасекар".
Ако масата на бялото джудже надвишава 1,4 слънчеви маси (границата на Чандрасекар), силата на гравитационното привличане ще застави протоните и електроните вътре в звездата по двойки да се обединят в неутрони. Но неутронът както електрона , също е фермион (има спин 1/2) и също като електрона се подчинява на принципа на Паули и има нужда от "жизнено пространство". И тогава неутроните, също като електроните в белите джуджета, започват да произвеждат вътрешно налягане, което се наричат налягане на изроден неутронен газ и в този случай гравитационното колапс на звездата спира на етапа образуване на неутронна звезда с диаметър 7-15км.
Но ако масата на звездата е била още по-голяма - около 30 пъти слънчевата маса, гравитацията ще сломи и съпротивлението на изродения неутронен газ и звездата ще се свие още, превръщайки се в черна дупка.
Еволюцията на звездите. Схема: store.steampowered.com
Източници:
Pauli exclusion principle
Fermions vs Bosons Near Absolute Zero
Принцип запрета Паули
Предел Чандрасекара
Multiparticle Wavefunctions and Symmetry, Michael Fowler, University of Virginia
What's this Higgs boson anyway ?
Binary Unity: The Pauli Exclusion Principle























Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
dolivo
Земята потъмнява. Какво означава тази тревожна климатична тенденция за бъдещето?
Nikor
На 30 септември 1928 е открит пеницилинът
Прост Човек
Ново обяснение за гигантските експлодиращи кратери в Сибир
dolivo
Климатичният скептицизъм – най-скъпата лъжа на нашето време