
Новаторско изследване на учени от Националната ускорителна лаборатория SLAC и Станфордския университет разкрива процеса, чрез който малка клетъчна машина, наречена TRiC, контролира сгъването на тубулина - човешки протеин, който е в основата на микротубулите, действащи като структурна опора и транспортна система на клетките.
Това оспорва досегашното разбиране, че TRiC и други подобни машини, известни като шаперонини, само пасивно създават благоприятна среда за сгъване, но не участват активно в него.
Изследователите смятат, че до 10% от протеините в нашите клетки, както и тези в растенията и животните, получават практическа помощ от тези малки камери при сгъването им в крайната им активна форма.
Много от протеините, които се сгъват с помощта на TRiC, са тясно свързани с човешки заболявания, включително някои видове рак и невродегенеративни разстройства като болестите на Паркинсон, Хънтингтън и Алцхаймер, обяснява професор Джудит Фридман (Judith Frydman) от Станфорд, един от водещите автори на изследването.
Всъщност, отбелязва тя, много от противораковите лекарства са разработени така, че да разрушават тубулина и образуваните от него микротубули, които са наистина важни за клетъчното делене. Така че насочването към процеса на сгъване на тубулина, подпомаган от TRiC, би могло да осигури интересна противоракова стратегия.
Тази анимация представя 3D изглед на завършена, сгъната молекула тубулин, която все още е прикрепена към две субединици на клетъчна машина, наречена TRiC. Знаково проучване на изследователи от SLAC и Станфорд разкри, че вътрешните стени на камерата TRiC активно насочват сгъването на TRiC в крайната му активна форма. Кредит: Yanyan Zhao/Stanford University
Екипът докладва резултатите от своето десетилетно проучване в статия, публикувана в списание Cell.
"Това е най-интересната протеинова структура, върху която съм работил през 40-годишната си кариера", коментира професорът от SLAC/Stanford Уах Чиу (Wah Chiu), пионер в разработването и използването на криогенна електронна микроскопия ("cryo-EM") и директор на отдела за крио-ЕМ и биоизображения на SLAC.
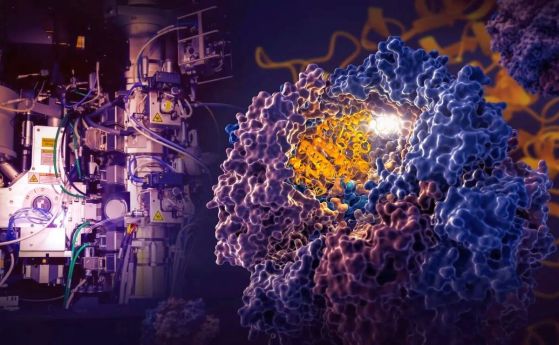
 Стъпки на сгъване на протеини. Проучване на SLAC-Stanford разкри четири междинни стъпки при сгъването на човешкия протеин, наречен тубулин, като всички те се направляват от вътрешните стени на клетъчна машина, наречена TRiC (жълто). Процесът започва, когато една нишка тубулин влиза в камерата на TRiC. Единият край (зелен) се закача за вътрешната стена на камерата; след това другият край (светлосин) се закача на друго място и се сгъва, последван от зеления край и още две сгъвания на средните участъци (тъмносин и червен). Сгъването се насочва от областите с електростатичен заряд върху вътрешната стена и от "опашките" на протеина, висящи от вътрешната стена, които задържат и стабилизират протеина в правилната конфигурация за следващата стъпка в сгъването. Ядрото на белтъка (тъмносиньо) съдържа джобове (оранжево), в които се включва GTP - молекула, която съхранява и освобождава енергия за работата на клетката. Кредит: Yanyan Zhao/Stanford University
Стъпки на сгъване на протеини. Проучване на SLAC-Stanford разкри четири междинни стъпки при сгъването на човешкия протеин, наречен тубулин, като всички те се направляват от вътрешните стени на клетъчна машина, наречена TRiC (жълто). Процесът започва, когато една нишка тубулин влиза в камерата на TRiC. Единият край (зелен) се закача за вътрешната стена на камерата; след това другият край (светлосин) се закача на друго място и се сгъва, последван от зеления край и още две сгъвания на средните участъци (тъмносин и червен). Сгъването се насочва от областите с електростатичен заряд върху вътрешната стена и от "опашките" на протеина, висящи от вътрешната стена, които задържат и стабилизират протеина в правилната конфигурация за следващата стъпка в сгъването. Ядрото на белтъка (тъмносиньо) съдържа джобове (оранжево), в които се включва GTP - молекула, която съхранява и освобождава енергия за работата на клетката. Кредит: Yanyan Zhao/Stanford University
Изследователите улавят четири отделни стъпки в процеса на сгъване, насочен от TRiC, с почти атомна резолюция с помощта на cryo-EM и потвърждават видяното с биохимични и биофизични анализи.
На най-основно ниво, посочва Фридман, това изследване решава дългогодишната загадка защо тубулинът не може да се сгъва без помощта на TRiC:
"Това наистина променя правилата на играта, тъй като най-накрая дава нов начин да се разбере как се сгъват протеините в човешката клетка."
Сгъване на спагети като цветя
Протеините играят съществена роля в почти всичко, което прави клетката, и откриването на начина, по който те се сгъват в крайното си 3D състояние, е едно от най-важните търсения в химията и биологията.
Както казва Чиу, "един протеин започва като низ от аминокиселини, който прилича на спагети, но не може да функционира, докато не се сгъне в цвете с правилната форма."
От средата на 50-те години на миналия век представата ни за това как се сгъват протеините се оформя от експерименти, проведени с малки протеини от изследователя от Националния институт по здравеопазване Кристиан Анфинсен (Christian Anfinsen). Той открива, че ако разгъне малък белтък, той спонтанно ще се върне в същата форма, и стига до заключението, че указанията за това са кодирани в аминокиселинната последователност на протеина. За това откритие Анфинсен получава Нобелова награда за химия през 1972 г.
Тридесет години по-късно изследователите откриват, че специализирани клетъчни машини помагат на протеините да се сгъват. Но преобладаваше мнението, че функцията им се ограничава до подпомагане на протеините да извършват спонтанното си сгъване, като ги предпазват от улавяне или слепване.
Един вид помощна машина, наречена шаперонин, съдържа подобна на бъчва камера, която задържа протеините вътре, докато те се сгъват. TRiC се вписва в тази категория.
Камерата на TRiC е уникална, тъй като се състои от осем различни субединици, които образуват два подредени пръстена. Дълга, тънка нишка от тубулинов протеин се доставя в отвора на камерата от помощна молекула с форма на медуза. След това капакът на камерата се затваря и започва сгъването. Когато то приключи, капакът се отваря и завършеният сгънат тубулин напуска камерата.
Тъй като тубулинът не може да се сгъне без TRiC, се оказа, че TRiC може да прави нещо повече от пасивно подпомагане на спонтанното сгъване на тубулина. Но как точно става това? Това ново изследване дава отговор на този въпрос и показва, че поне за протеини като тубулина концепцията за "спонтанно сгъване" не е приложима. Вместо това TRiC директно организира пътя на сгъване, водещ до правилно оформен протеин.
Въпреки че последните постижения в областта на изкуствения интелект ('AI') могат да предскажат завършената, нагъната структура на повечето протеини, Фридман отбелязва, че изкуственият интелект не показва как даден протеин постига правилната си форма. Това знание е от основно значение за контролиране на сгъването в клетката и за разработване на терапии за заболявания, свързани със сгъването. За да постигнат тази цел, изследователите трябва да разберат подробните етапи на процеса на сгъване, докато той протича в клетката.
 Кристалната структура на шаперонина, огромен протеинов комплекс. Маркирана е една протеинова субединица. Шаперонините подпомагат сгъването на протеините. Кредит: Thomas Splettstoesser (CC BY-SA 3.0)
Кристалната структура на шаперонина, огромен протеинов комплекс. Маркирана е една протеинова субединица. Шаперонините подпомагат сгъването на протеините. Кредит: Thomas Splettstoesser (CC BY-SA 3.0)
Как работи клетъчната камера
Преди десет години Фридман, Чиу и техните изследователски екипи решават да вникнат по-дълбоко в това, което се случва в камерата TRIC.
"В сравнение с по-простите камери за сгъване на шаперонини в бактериите, ТРИК в човешките клетки е много интересна и сложна машина", обяснява Фридман. "Всяка от осемте му субединици има различни свойства и представлява отделна повърхност вътре в камерата, а това се оказва наистина важно."
Учените откриват, че вътрешността на тази уникална камера насочва процеса на сгъване по два начина.
Когато капакът на камерата се затваря над протеина, по вътрешните ѝ стени се появяват области с електростатичен заряд. Те привличат противоположно заредени части от протеиновата нишка на тубулина и по същество ги прикрепват към стената, за да създадат правилната форма и конфигурация за следващата стъпка в сгъването. Междувременно "опашките" на субединицата TRiC, които висят от стената на камерата, хващат тубулиновия протеин в определени моменти и на определени места, за да го закрепят и стабилизират.
В началото единият край на тубулиновата нишка се закача в малко джобче в стената. След това другият край се закача на друго място и се сгъва. След това краят, който се е закачил за стената, се сгъва по начин, който го доближава до първото сгънато място.
В третата стъпка част от средната част се сгъва, за да образува ядрото на протеина, заедно с джобове, в които може да се включи GTP - молекула, която съхранява и освобождава енергия за работата на клетката.
Накрая се сгъва останалата част от протеина. Молекулата на тубулина вече е готова за действие.
"Тези структурни снимки на междинните етапи в последователността на сгъване никога досега не са били наблюдавани чрез криоелектронна микроскопия", заявява Фридман.
Мощна комбинация от техники
Екипът на Фридман потвърждава последователността на сгъване с трудна поредица от биохимични и биофизични тестове, които изискват години работа.
Интерпретирането на тези резултати позволява на изследователите да изградят картина на променящата се форма на тубулина при сгъването му в камерата TRiC, която съвпада с изображенията, генерирани чрез криоелектронна електроника.
"Много е важно да можем да използваме тези техники, защото тогава наистина можем да сме сигурни, че това, което виждаме, отразява случващото се в клетката", заявява Фридман.
"Науката ни изненада с едно наистина интересно решение, което не бих предвидил."
Изследването също така дава ключ към разбирането на това как тази система за сгъване е еволюирала в еукариотните клетки, от които се състоят растенията, животните и хората, но не и в по-простите клетки като тези на бактериите и археите. Изследователите предполагат, че в един момент, когато протеините са ставали все по-сложни, за да обслужват нуждите на еукариотните клетки, те не са могли да се сгъват във формите, необходими за изпълнението на по-сложни задачи, без малко помощ. Еукариотните протеини и тяхната шаперонинова камера вероятно са еволюирали заедно, вероятно започвайки от последния общ предшественик на всички еукариотни организми преди около 2,7 милиарда години.
Справка: “Structural visualization of the tubulin folding pathway directed by human chaperonin TRiC/CCT” by Daniel Gestaut, Yanyan Zhao, Junsun Park, Boxue Ma, Alexander Leitner, Miranda Collier, Grigore Pintilie, Soung-Hun Roh, Wah Chiu and Judith Frydman, 8 December 2022, Cell.
DOI: 10.1016/j.cell.2022.11.014
Източник: Profound Implications: New Research Challenges a 70-Year-Old Theory of Protein Folding
SLAC National Accelerator Laboratory
















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон
dolivo
Сахара очаква 75% увеличение на валежите до 2100 г.
dolivo
Земната ябълка: стара култура за новите климатични времена