
Всички гледали „Доктор Хаус” може би си спомнят за един от лекарите, помагащи в разрешаването на загадките – Номер Тринадесет. Тя страдаше от доста рядко заболяване, наречено болест на Хънтингтън. То представлява неврологично увреждане, доскоро нелечимо, но изследвания с метода CRISPR/Cas9 при мишки дават нова надежда за болните от него.
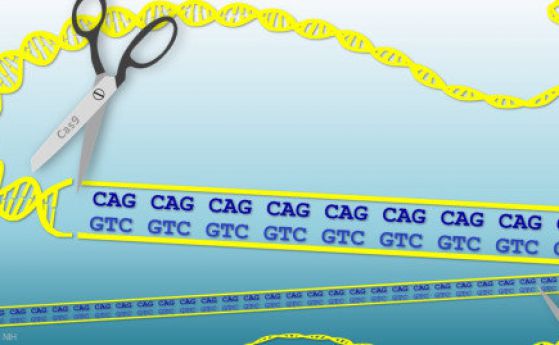
През 1993 изследователи идентифицират гена, причиняващ Хънтингтън. Болестта се получава, когато даден човек унаследи от единия родител мутантно копие на гена Хънтингтън (HTT), в който има допълнителни повторения на три букви (CAG) от четирибуквения код на ДНК. Това води до производството на неправилно нагънат протеин, който е токсичен за мозъчните неврони, давайки начало на дегенеративен процес с течение на времето водещ до промени в настроението, неясна реч, некоординирани движения и накрая смърт. Симптомите се появяват между тридесет и петдесетгодишна възраст и се влошават в следващите десет до двадесет години. Всяко дете на родител с Хънтингтън има 50/50 шанс да наследи разширения ген. Ако детето не го унаследи, той или тя никога няма да развие заболяването и да го предаде на своите деца.
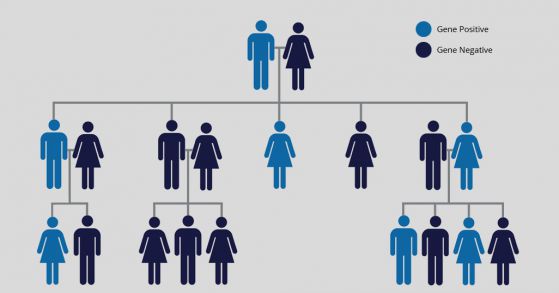
В тъмно синьо са означени хора, неносещи гена, а в светло синьо-носещите го. Източник: http://hdsa.org/what-is-hd/
Болестта засяга двата пола, както и всички раси и етноси по света. Средно в 10% от случаите, Хънтингтън засяга деца или юноши. Симптомите на младежки Хънтингтън са до известна степен различни от тези на заболяването при възрастни и може да включват непохватно ходене, тромавост и затруднения в речта. Способността за заучаване на нови неща може да намалее и детето може да загуби умения, придобити по-рано. Младежкият Хънтигтън се развива по-бързо от този при възрастните.
При ново изследване, включващо миши модели на болестта на Хънтингтън изследователите Са Ян, Ренбао Циен, Сяо-Дзян Ли (Su Yang, Renbao Chang, Xiao-Jiang Li) и колеги в Университетски колеж Емъри в Атланта (Emory University School of Medicine, Atlanta) са успели да спрат производството на анормалния протеин с помощта на CRISPR/Cas9, който е изрязал повтарящата се част.
Предишната работа на изследователите е показала, че спирането на производството на мутиралия или даже здравия HTT протеин в напълно развити неврони не наранява клетките и не причинява видими неврологични проблеми в мишките. Така че изследователите се заели с ивичестото тяло – част от мозъчния ствол, която контролира моторните умения. Сега те искали да видят дали спирането на НТТ продукцията при милиони неврони в ивичестото тяло може да обърне ранните признаци на болестта. Тя обикновено се появява в засегнатите мишки преди да станат на 9 месеца.
За да получат отговор, те са инжектирали неактивни вирусни частици директно в ивичестото тяло на няколко деветмесечни мишки, създадени да произвеждат мутантна форма на НТТ протеина. Всяка частица като Троянски кон доставя към невроните една от двете части на CRISPR/Cas9 системата: или кратка насочваща РНК – за да отбележи CAG повторението в НТТ гена, и подобния на ножица Cas9 ензим – за да ги премахне. При тази стратегия са „изчистени” едновременно здравите и ненормалните копия на НТТ гена и в крайна сметка липсва продукция на НТТ протеин.
Забележителното е, че три седмици по-късно учените откриват, че системата CRISPR/Cas9 е обърнала болестния процес в техния миши модел. Невроните в ивичестото тяло са спрели да произвеждат протеина НТТ. Още повече – ненормалния протеин НТТ, който вече бил събран в или около невроните и който вероятно би ги убил, започнал да се изчиства в различна степен при мишките. Същото се случило и с други протеинови аномалии, свързани с прогресирането на болестта на Хънтигтън.
Има и още по-добри новини. Екипът повторил инжекциите със системата CRISPR/Cas9 в ивичестото тяло на десетина деветмесечни мишки и получил подобен изчистващ протеините ефект. Тогава в следващите три месеца изследователите открили, че баланса на животните, мускулната координация и подвижността им са се подобрили, сравнени с мишките, на които са дадени фалшиви инжекции с CRISPR/Cas9. Интересното е, че степента на подобрение при техните моторни умения съответствала на количеството токсичен протеин, което е премахнато от ивичестото тяло.
Колкото и вълнуващо да е редактирането на гени като потенциално лечение за болестта на Хънтигтън, изследването е все още в много ранен стадий. Например, учените от Емъри са способни да установят, че възрастните мишки могат да живеят и без функционално копие на НТТ, но остава неизяснен въпроса дали това е така и при хората.
Друг потенциален проблем със сигурността е редактирането, което не попада в целта (off-target editing). В статията „Неочаквани мутации след CRISPR/Cas9 редактиране in vivo” от Шафер и екип (Unexpected mutations after CRISPR-Cas9 editing in vivo from Schaefer KA) е съобщено, че CRISPR/Cas9 понякога може да се заблуди и отреже здрави гени при изследвания с животни, като при това може да предизвика хиляди нежелани мутации. Учените от Емъри обаче съобщават, че такова погрешно редактиране не изглежда да е голям проблем в тяхното последно изследване. Секвенирането на геномната ДНК взета от ивичестото тяло на мишките показва, че редактирането с CRISPR/Cas9 се случва „преобладаващо” около техните целеви секвенции без значително геномно редактиране в най-вероятните извънцелеви локации. Въпреки че това е само едно изследване, това все пак са успокояващи новини на фона на продължаващите изследвания на терапевтичния потенциал на CRISPR/Cas9 методиката.
Използването на CRISPR/Cas9 за лечение на болестта на Хънтингтън е само още един пример за това как тази мощна нова технология може да бъде приложена към хиляди заболявания, причинени от специфична мутация в ДНК; методът вече в впрегнат в изследвания и на други заболявания като сърповидно-клетъчна анемия* и мускулна дистрофия**.
*Сърповидно-клетъчна анемия – заболявание, при което червените кръвни клетки имат неправилна форма. Те могат да се залепят за стените на кръвоносните съдове, причинявайки блокаж, който забавя или спира потока на кръвта. Когато това стане, кислородът не може да достигне околните тъкани. Липсата на кислород причинява внезапни пристъпи на остра болка, наречени болкови кризи. Сърповидната форма и нарушеното пренасяне на кислород може да причини също и увреждания на органите. През болните от това заболяване, могат да се увредят далака, мозъка, очите, белите дробове, сърцето, бъбреците, пениса, ставите, костите или кожата.
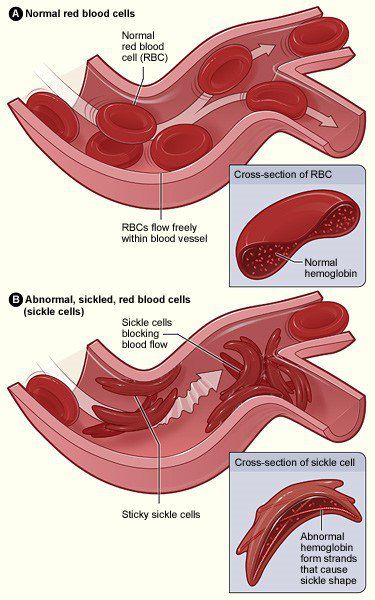
А) нормални червени кръвни телца B) червени кръвни телца при сърповидно-клетъчна анемия Източник: https://www.nhlbi.nih.gov/health/health-topics/topics/sca
**Мускулна дистрофия – група от заболявания, които причиняват прогресивно отслабване и загуба на мускулна маса. При тях анормалните гени пречат на нормалната продукция на протеините, необходими за образуването на здрави мускули. Има различни типове мускулна дистрофия. Симптомите на най-често срещаните разновидности започват в детството, първоначално при момчетата. Други типове не се появяват преди зрялата възраст. Някои болни загубват способността да ходят. Други имат трудности в дишането или преглъщането.
Използвани източници:
https://www.nhlbi.nih.gov/health/health-topics/topics/sca
http://www.mayoclinic.org/diseases-conditions/muscular-dystrophy/basics/definition/con-20021240
Още по темата
Животът
За първи път е редактиран ген в еднодневен ембрион

Животът
Златният медалист по биология: "В училище буксуваме на открития, актуални за 19 и 20 век"
Животът
Първите човешки ембриони успешно са редактирани в САЩ


















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон