
Огромният успех на трансплантацията като животоспасяваща терапия за лечение в крайния стадий на органна недостатъчност увеличава необходимостта от органи. В момента в САЩ над 108 000 души очакват органи, но по-малко от 40 хиляди трансплантации се извършват годишно.
Основна причина е недостигът на донори.
Затова се прилага ксенотрансплантация, при която се използуват органи от животни. Най-вече прасета като най-близки по размер и имунологично до човека.
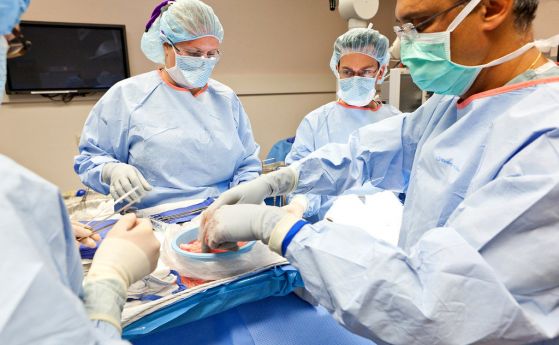
На 7 януари 2022 за първи път на човек е трансплантирано сърце от прасе.
Дейвид Бенет, на 57 години, е опериран в Балтимор, Мериленд, на 7 януари, като е използвано сърце от прасе, което е генетично модифицирано, за да се увеличат шансовете му да не бъде отхвърлено от човешко тяло. Бенет е бил в безнадежно състояние преди операцията и поради това не може даже да е кандидат за сърце от донор. Операцията се извършва извън всякакви клинични изпитания, съобщава Stat news.
Трансплантираното сърце е от прасе, разработено от американската фирма Revivicor. Общо в животното са модифицирани 10 гена. Четири от тях са инактивирани, включително един, който предизвиква агресивен имунен отговор, и един, който в противен случай би накарал сърцето на прасето да продължи да расте след трансплантация в човешко тяло.
Компанията Revivicor не споделя какви методи са използвани за тези генни модификации. За да се увеличат още повече шансовете на пациента, в генома на прасето-донор са вмъкнати шест човешки гена, а пациентът Бенет приема, освен това, лекарства за потискане на реакцията на имунната система. До момента на публикуване на тази история в пресата Бенет се справя добре с новото сърце, но все още не е изключен от апарата за байпас на сърцето и белия дроб, който поддържа неговата функция. Лекарският му екип заяви пред "Ню Йорк Таймс", че сърцето на животното върши по-голямата част от работата и че засега сърцето "изглежда нормално".
"Това е голяма крачка напред - може да се сравни с първото кацане на Луната", казва Йоахим Денер (Joachim Denner) от Свободния университет в Берлин.
Бъбрек от генетично модифицирано прасе от същата фирма бе трансплантиран през октомври в пациент в клинична смърт, поддържан на системи. Бърбрекът показва за дълго успешна работа. Това става, без да бъде отхвърлен от имунната система на организма.
Друг начин за доказване на приложимостта на подхода е с присаждане на свинските органи na маймуни. Маймуните, подобно на човека, също биха отхвърлили орган на прасе, ако той не е генно модифицирано по подходяш начин. Вътрешният потенциал за растеж на свинските ксенооргани може да влоши дългосрочната им функция след трансплантация в маймуните. Тъй като растежният хормон е основен стимулатор на постнаталния растеж, премахнахват неговия рецептор (GHR-KO), за да се намали размера на донорските прасета. Показано е, че бабуни с прасешки сърца преживяват до 945 дена.
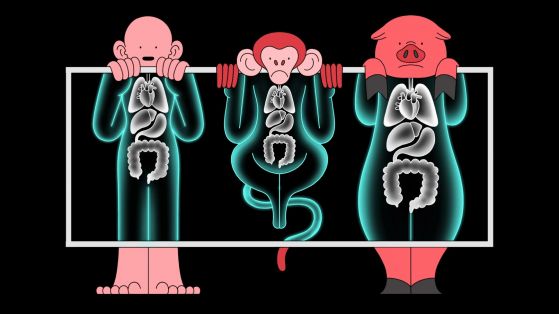 Рентген на човек, маймуна и прасе. Кредит NAN LEE
Рентген на човек, маймуна и прасе. Кредит NAN LEE
Ето някои подробности за приложения метод с генeтично модифицирани прасета.
Три от прасешките гени, които са инактивирани, кодират ензими, GGTA1, B4GALNT2, и CMAH, които синтезират антигени, предизвикващи имунна реакция у човека.
α1,3-галактозил-трансфераза GGTA1 включват галактози в мембраните на прасешките клетки . Галактоза-алфа-1,3-галактоза, известна като алфа гал е въглехидрат, който се съдържа в клетъчните мембрани на повечето бозайници.
|
Този олигозахарид не се среща при приматите, включително хората, които са загубили гена GGTA1. Тяхната имунна система го разпознава като чуждо тяло и произвежда ксенореактивни имуноглобулинови М антитела, което води до отхвърляне на органи след трансплантация. Антиалфа-гал имуноглобулиновите антитела са едни от най-често срещаните при хората. Редовното им стимулиране от чревната флора, което обикновено започва през първите шест месеца от живота, води до изключително висок титър от около 1 % от всички циркулиращи IgG. предполага се също, че алфа гал играе роля в IgE-специфичната алергична реакция към някои видове месо.Синтезът на алфа-гал изисква ген, кодиращ алфа-1,3-галактозилтрансфераза. При хората и висшите примати този ген не функционира, поради което тези видове не могат да произвеждат алфа-гал – и затова те произвеждат IgG антитела, насочени срещу този олигозахарид. |
Инактивирането на галактозил-трансферазата премахва „захарната глазура“ от мембраните на клетките в прасето, и с това елиминира необходимостта от имунната реакция след присаждане на органа в човека или маймуната.
В генома на α1,3-галактозилтрансфераза (GGTA1)-дефицитни прасета, се вмъкват гени за човешки клъстер на диференциация 46 (hCD46) и човешки тромбомодулин (hTHBD).
Други изявени ксено-антигени са N-ацетил-неураминова киселина (Neu5Gc), синтезирана от цитидинмонофосфат-N-ацетил-неураминова киселинна хидроксилаза (CMAH), и Sd(a)-подобен гликан, направен от свинската β-1,4-N-ацетил-галактозаминил трансфераза B4GALNT2. Съответно, гените на тези ензими трябва да се нокаутират, за да се избегне имунната реакция след трансплантация.
Тази поредица от генни модификации е забележителна. Тя щеше да е невъзможна преди десетина години, но методът CRIPSR даде страхотно оръжие в ръцете на генните инженери.
Прасенцата са опасни и с това, че носят свински ендогенни ретровируса (PERV). Те стоят в сянка и не проявяват активност. Тези PERV последователности „в сянка“ са целта преди няколко години на експеримент на генетика Джордж Чърч от Харвардския университет и неговите колеги. Те даже създават фирма за това eGenesis.
С помощта на CRISPR – метода екипът на Чърч проектира насочваща РНК, която е насочена към ген, общ за всички 62 последователности на PERV в ДНК на свински бъбречни клетки. В малка подгрупа от тези клетки системата CRISPR заличава всеки екземпляр на прицелния ген - това е най-големият брой генни промени, постигнати дотогава с един CRISPR „удар“. И тези редактирани клетки показват до 1000 пъти намаляване на способността си да заразяват човешки бъбречни клетки с PERV.
„Това, че клетките изобщо са оцелели, след като тяхната ДНК е била нарязана на 62 места, е забележително“, казва молекулярният биолог Дженифър Даудна от Калифорнийския университет в Бъркли, един от първоначалните разработчици на CRISPR.
Ето как изглеждат тези невинни клонирани прасенца с геном „почистен“ на 62 места от ретровирусни последователности :
 Кредит: doi: 10.1126/science.aan7227
Кредит: doi: 10.1126/science.aan7227
За да се получат необходимите генетични модификации, се започва с култивиране на соматични прасешки клетки. С генетична инженерия, най-вече методът CRISPR се нокаутират вредните прасешки гени, или се вмъкват необходими човешки гени. След това ядрата на тези клетки се инжектират в енуклеирани свински овоцити (т.е. с извадени клетъчни ядра). Такъв подход - SCNT (соматичен клетъчен ядрен транфер), бе използуван при клонирането на овцата Доли преди четвърт век.
Схемата на фирмата Revivcor e следната :
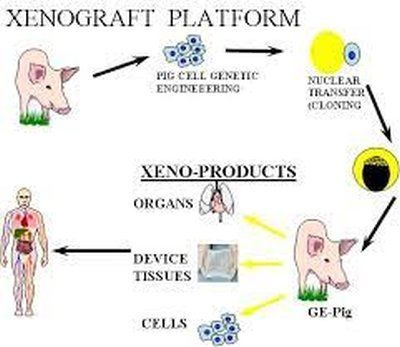 Кредит: REVIVCOR
Кредит: REVIVCOR
Получените клонирани генно модифицирани прасета могат да се използуват за култивиране на клетки от тях, за изработване на тъканни приспособления(кожни графтове и др.) или за органи.
В резултат на разработките фирмата REVIVCOR предлага сърца, бял дроб, черен дроб, стомах и бъбреци.
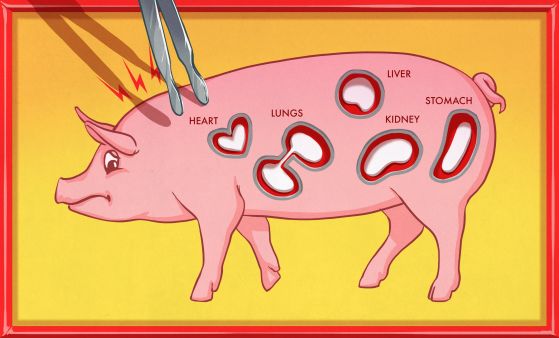 Кредит: HACKADAY.COM и REVIVICOR
Кредит: HACKADAY.COM и REVIVICOR
Литература:
What does the first successful test of a pig-to-human kidney transplant mean?, Science News
How a pig heart was transplanted into a human for the first time, NewScientist

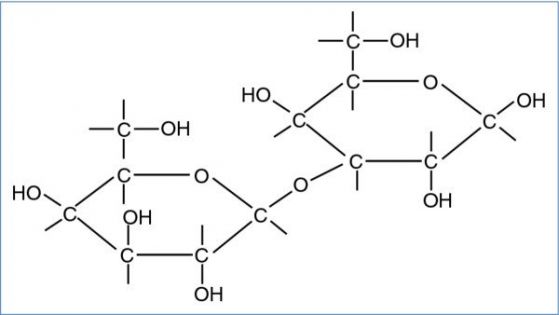 galactose alpha(1,3)-galactose
galactose alpha(1,3)-galactose
















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон