

Учени откриха, че майчините активни епигенетични модификации задвижват генната активност на поколението. Тези модификaции са в конкуренция с репресивни епигенетични модификaции и майката се грижи да поддържа правилния баланс на клетъчно ниво.
Родителите предават гени на своето поколение, за да служат в бъдещия живот. Те не предават от поколение на поколение само гени, но и информация за активирането им. Човешката майка отглежда девет месеца бебето в утробата си. Години наред децата се отглеждат и обучават в прости и сложни дейности за оцеляване. Плодовите мушици (дрозофила) снасят яйца, които са оставени да се развиват сами. Изоставянето на малките изглежда безотговорно. Но едно ново изследване от лабораторията на Асифа Актар от Макс Планк И-тута по Имунобиология и Епигенетика (Фрайбург), показва, че мушиците-майки осигуряват на потомството си наръчник за живота, закодиран епигенетично. (Публикация 1)
От геном към епигеном
Генетичната информация от нашите родители е кодирана в ДНК. Но, макар че всички клетки в тялото съдържат една и съща ДНК, те експресират различни гени за да изпълнят различни функции. ДНК е опакована около хистонови белтъци, оформящи една повтаряща се единица наречена нуклеозома. Много нуклеозоми заедно оформят хроматина в ядрата на всички клетки. Епигенетични модификации, добавящи химични групи към хистоните, водят до промени в хроматиновата организация, което или активира, или потиска експресията на гените. Епигенетиката дава допълнителен слой информация, определяйки кои гени да са активни. Така че клетките в тялото ни освен общ геном притежават различни епигеноми.
Родителските полови клетки, овоцити и сперматозоиди, се сливат при оплождането и дават начало на нов организъм. Предполага се, че повечето епигенетични маркировки се изтриват между поколенията. Така всички гени се „четат“ наново за всеки нов индивид. Но групата на Актар открива, че една специфична хистонова модификация, ацетилирането на 16-тия лизин на хистона Н4 (Н4К16ас) се запазва и предава от майчината овоцитна клетка към младия ембрион. Тази модификация обикновено е свързана с активиране на гени. В овоцитата и в първите три часа от живота на ембриона гените не работят, не се експресират. Какво прави епигенетичният маркер Н4К16ас в този ранен етап? Учените намират много области на ДНК маркирани с Н4К16ас по време на ранните стадии от ембрионалното развитие преди началото на генната активност (ZGA).
Предаване на епигенетична информация от майката на следващото поколение
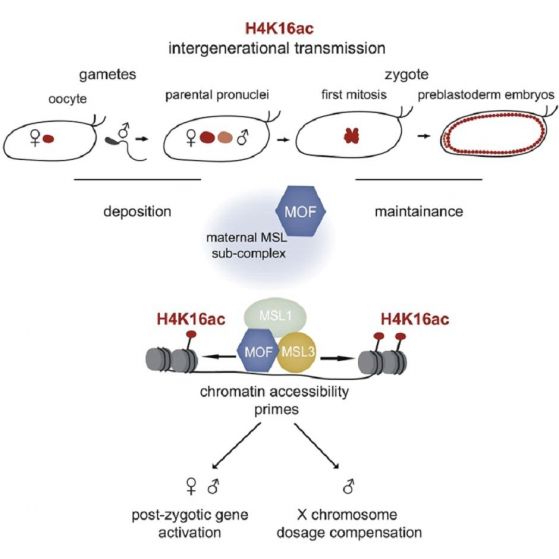
След сливането на гаметите събитията в развитието се управляват от майчини мРНК-и и белтъци преди активиране на генома на зиготата. Самата и сътр. Показват, че майчината зародишна линия подготвя гени за бъдещо активиране чрез предаване на хистона Н4 с ацетилиран лизин К16. Белтъчният комплекс MSL (MOF, MSL1, MSL3) е необходим за да се поддържа нивото на ацетилиране, което прави хроматина достъпен за транскрипция, без което не може да започне самостоятелната генна активност в зародиша.
При Дрозофила и при бозайници това ацетилиране се предава от овоцитите към зародишите. Хистоновата ацетилтрансфераза MOF извършва посттранслационната модификация на хистона Н4 - H4K16ac. MOF е част от комплекс белтъци – MSL (MSL1, MSL2, MSL3, MOF, and MLE). Тези белтъци се доставят и предават само по майчина линия като белтъци и транскрипти (РНК), които са стабилни в ранните ембрионални стадии, когато няма транскрипция. Това подготвя промоторите за бъдещото активиране на гените. Достъпността на промоторните участъци в нуклеозомите преди ZGA (активирането на гените на зародиша) се поддържа от H4K16ac заедно с ацетилтрансферазата MOF. Ако майчината МОF липсва, ацетилирането изчезва, тримерната организация на активните геномни области се нарушава и РНК полимераза II работи неправилно.
Mайчините епигенетични съвети са важни за ембрионалното развитие
Това се установява, когато предаването на епигенетичния маркер H4K16ac от майката към нейните деца е осуетено. Изследвайки трансгенни мухи, в които е премахнат ензима MOF, авторите на статията установяват, че гените, които вече не са маркирани от H4K16ac, имат нарушена хроматинова организация и дейността на РНК полимераза II е компрометирана. Повечето ембриони, неуспели да получат инструктивния майчин маркер H4K16ac, умират с катастрофални зародишни дефекти. Така че H4K16ac носи инструктивна функция в зародиша, необходима за развитието на ембриона по-нататък.
„Сякаш майката е оставила стикери- бележки с инструкции къде се намира храната или на кого да се обадят по спешност и т.н., когато детето е само в къщи за първи път“, казва Мария Самата, водещ автор в статията.
Авторите идентифицират 7000 гена с промотори, позитивни за Н4К16ас. Това води до нуклеозомни конформации, които правят хроматина архитектурно достъпен за транскрипция. Така че действието на Н4К16ас върху транскрипцията (т.е. генната активност) е непряко - чрез отваряне на хроматиновата структура.
Премахването на хистонови деацетилази в зародишната линия показва, че други ацетилни модификации не могат да компенсират загубата на H4K16ac в овоцитите. Интересно е също, че ре-експресия на MOF в зародиша не може да компенсира липсата на майчин MOF. Това означава, че майчиният принос е незаменим и на молекулно ниво. МОF не само ацетилира Н4К16, но и поддържа това ацетилиране от зрелите овоции през първите няколко ембрионални деления.
От мухите до хората
По думите на Асифа Актар, това, че майките-мухички осигуряват успеха на поколението си чрез епигенетика още преди оплождането, е забележителен резултат. Учените изследват и намират, че женски мишки също предават хистоновата модификация Н4К16ас на поколението си чрез своите овоцити през овогенезата, през мейозите и първите митози в зародиша. Това води до интересната възможност, че и при човека майките може да използуват H4K16ac, помагайки на плана за успешно ембрионално развитие по начин, който бъдещи изследвания вероятно ще покажат.
(Заб. Не може да не отбележим, че основен съавтор в работата е д-р Пламен Георгиев, възпитаник на Соф. У-тет и на И-тута по Молекулярна биология).
Но това не е единственият пример за „майчина намеса“ в развитието на поколението - (Публикация 2): Лизин (К) специфична хистон-деметилаза KDM4A регулира прехода от майка към зародиш като предпазва обширни области от хроматина, в които преоладават нуклеозоми с метилиран Н3К4ме3 (епигенетичен маркер за генна активност, разположен в нуклеозоми край промоторните области на гените) от разпространението на репресивния маркер Н3К9ме3, характерен за компактния генетично неактивен хетерохроматин. Така че по време на овогенезата и след това (две мейотични деления и следващите митотични деления на зиготата в хроматина се води.
Битка между активни и репресивни епигенетични маркери
Зрелите овоцити са транскрипционно тихи, но имат големи области с триметилиран четвърти лизин на хистон Н3 - H3K4me3 (bdH3K4me3). Ензимът KDM4A деметилира деветия лизин на хистона Н3 - H3K9me3 в тези области и е критично важен за нормалното преимплантационно развитие и за геномната активация на зиготата след оплождането. Без този ензим в овоцитите Н3К9ме3 аномално се разпростира върху областите bdH3K4me3, което води до недостатъчна транскрипционна активност на гени по време на ZGA. Така че KDM4A е съществен за запазване на майчината епигеномна организация, необходима за правилното развитие на ембриона.
Фигура 1: KDM4A пречи на акумулиране на H3K9me3 в овоцити и предпазва транскрипционното заглушаване в зародиша.

a, Схема на динамиката на разполагането на H3K4me3 и H3K9me3 и ремоделирането от зрял овоцит до двуклетъчен зародиш в див тип мишки (с действащ ензим KDM4a+/+) . MLL2 катализира добавяне на H3K4me3 в зелените области (bd), докато KDM4A, ангажирана в същите области, катализира премахването на H3K9me3 (сини области) от тях. Транскрипционното състояние на растящи овоцити и на МII овоцити (второ мейотично деление) e показано в ляво.
b, Kdm4a–/– овоцити (с нокаутиран ензим KDM4A) получават H3K9me3 в области, носещи Н3K4me3 (сини със зелени точки) – които стават бивалентни (с активни и репресивни епигенетични маркери) и включват промотори и потенциални енхансери, които нормално са активирани на двуклетъчния стадий (горната схема в b). Макар че транскриптомът е само слабо засегнат в Kdm4a-нокаутирани MII овоцити, в зародиша на стадий две клетки (2С ембрион) активирането на гените (ZGA) e смутено (долна част на b). GO – растящи овоцити, 2C – стадий две клетки; ZGA активиране на гените в зародиша (зиготата); Н3К9-KMTase – лизин метил трансфераза – метилираща Н3К9; KDM4A- лизин деметилаза; MLL2, белтъчен комплекс (mixed-lineage leukemia 2).
Фигурата е по: Brind’Amour, J., Lorincz, M.C. Setting the chromatin stage in oocytes. Nat Cell Biol 22, 355–357 (2020).
Фигура 5: KDM4A регулира прехода майка--> зародиш чрез опазване на широките области, маркирани с активния H3K4me3, от интервенцията на репресивния епигенетичен маркер H3K9me3 в овоцити на мишка

a, Схемата показва времевата последователност при инжектирането на мРНК на Kdm4a и оплождането (в ляво). Процентите са на ембрионите, достигнали стадии морула и бластула, спрямо всички оплодени зиготи. Вдясно – снимки на прогреса в развитието на оплодените овоцити с добавена мРНК на див тип КDM4A (WT) или ензимно-мъртав мутант Н188 на ензима КDM4A mRNA.
b, Модел, показващ ролята на KDM4A в овоцитите за опазване на майчиния епигеном и осигуряване на правилна ZGA (зиготна генетична активация) за нормално преимплантационно развитие с WT-див тип и KO - с нокаутиран ензим). Майчиният епигеном с дивия тип не позволява разпростирането на Н3К9mе3 (в синьо) в хроматинови области, където Н3К4ме3 (в сиво) осигурява достъп до промоторите и правилна транскрипция и развитие на зародиша.
В тази битка за оцеляване на активно-епигенетично маркираните области оръжието е ензимът КDM4a, който поддържа областите с Н3К4mе3 като унищожава (деметилира) репресивното триметилиране на Н3К9. Зародишите на мишки без КDМ4а може да бъдат спасени ако в овоцити в статий МII (мейоза II) се инжектира каталитично активен KDM4a. Нещо, което не беше възможно с реекспресия на MOF в зародишите на дрозофили с овоцити без MOF (вж. по-горе дискусията - Публикация 1).
Майките–мухички оставят инструкции и за това какво да не правят децата, т.е. ембрионалните клетки, в първите етапи след оплождането (вж. Публикация 3). Това те постигат като овоцитите предават на първите поколения клетки на зародиша репресивния епигенетичен маркер Н3К27me3 както и ензимния комплекс PRC2, необходим за поддържане на този маркер през деленията преди и след зиготната генна активация. С това специфични области от хроматина се поддържат в неактивно състояние, със закачени „епигенетични“ бележки с надпис „забранено за транскрипция“. За разлика от случая, представен в Публикация 2, сега репресивният маркер Н3К27mе3 и хистон-метилтрансферазата EZ в комплекса PRC2 пречат на разпространението на активния епигенетичен маркер Н3К27ac в регулаторни области, важни при активирането на специфични гени в зиготата. И в този случай инструкциите трябва да идват от майчината яйцеклетка, а не на по-късен етап от развитието на зародиша. Ако е нарушено епигенетичното предаване на информация от яйцеклетката (PRC2 и Н3K27me3-белязаните хроматинови области), изходът е летален за зародиша. Не може на по-късен етап от ембрионалното развитие да се компенсира липсата на майчините инструкции с възстанoвяване на маркировката с Н3К27me3.
Разгледаните публикации дават примери за три подхода за онаследяване на епигенетична информация от майчините яйцеклетки през мейотичните и първите митотични деления на зародиша преди активацията на гените на зиготата. Тази информация се носи от посттранслационно-модифицираните хистонови лизини Н4К16ас и MOF-специфичната ацетилаза (Публ.1); или от Н3К4mе3 и хистон-деметилазата КDМ4, която пречи на репресивния епигенетичен маркер Н3К9ме3 (Публ.2); или от репресивния маркер Н3К27me3 заедно с поддържащия го ензимен комплекс PRC2, които пречат на активния маркер Н3К27ас (Публ.3).
Може само да се удивляваме от това какви фини механизми използувала природата в своята еволюция, както и от факта, че нивото на науката е достигнало до разкриване на тези интимни истини – ролята на майката на молекулно ниво.
***
Публикация 1: Maria Samata, Anastasios Alexiadis, Gautier Richard, Plamen Georgiev, Johannes Nuebler, Tanvi Kulkarni, Gina Renschler, M. Felicia Basilicata, Fides Lea Zenk, Maria Shvedunova, Giuseppe Semplicio, Leonid Mirny, Nicola Iovino, Asifa Akhtar. Intergenerationally Maintained Histone H4 Lysine 16 Acetylation Is Instructive for Future Gene Activation. 2020 Cell,182, 127-144. https://doi.org/10.1016/j.cell.2020.05.026
Резюме на Публикация 1: https://www.sciencedaily.com/releases/2020/06/200604152046.htm
Публикация 2: Аditya Sankar, Mads Lerdrup, Adeel Manaf, Jens Vilstrup Johansen, Javier Martin Gonzalez, Rehannah Borup, Robert Blanshard, Arne Klungland, Klaus Hansen, Claus Yding Andersen, John Arne Dahl, Kristian Helin & Eva R. Hoffmann „KDM4A regulates the maternal-to-zygotic transition by protecting broad H3K4me3 domains from H3K9me3 invasion in oocytes“. Nature Cell Biology 22, 380–388 (2020).
Резюме на Публикация 2 : Brind’Amour, J., Lorincz, M.C. Setting the chromatin stage in oocytes. Nat Cell Biol 22, 355–357 (2020).
Публикация 3: Fides Zenk , Eva Loeser, Rosaria Schiavo, Fabian Kilpert, Ozren Bogdanović , Nicola Iovino Germ line-inherited H3K27me3 restricts enhancer function during maternal-to-zygotic transition. Science. 14;357(6347):212-216. (2017)




















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
4I4ATA
Нов, скрит досега вход в пирамидата на Микерин е открит по аномалии при сканиране
YKoshev
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Johnny B Goode
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews