
–Ъ–Њ–≥–∞—В–Њ –±–µ –Њ—В–Ї—А–Є—В –њ—А–µ–і–Є –і–µ—Б–µ—В–Є–љ–∞ –≥–Њ–і–Є–љ–Є, –Ф–Э–Ъ-—А–µ–і–∞–Ї—В–Є—А–∞—Й–Є—П—В –µ–љ–Ј–Є–Љ CRISPR –њ—А–µ–і–Є–Ј–≤–Є–Ї–∞ —А–µ–≤–Њ–ї—О—Ж–Є—П –≤ –≥–µ–љ–љ–Њ—В–Њ –Є–љ–ґ–µ–љ–µ—А—Б—В–≤–Њ –Є –і–Њ–≤–µ–і–µ –і–Њ –Э–Њ–±–µ–ї–Њ–≤–∞ –љ–∞–≥—А–∞–і–∞ –Ј–∞ —Г—З–µ–љ–Є—В–µ.
–Р–Ї–Њ¬†–µ–њ–Є–≥–µ–љ–Њ–Љ–љ–Њ —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ —Б –њ–Њ–Љ–Њ—Й—В–∞ –љ–∞ –Љ–µ—В–Њ–і–∞ CRISPR –Љ–Њ–ґ–µ –і–∞ –њ—А–Њ–≥—А–∞–Љ–Є—А–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ–∞—В–∞ –њ–∞–Љ–µ—В –њ—А–µ–Ј –Љ–љ–Њ–≥–Њ –Ї–ї–µ—В—К—З–љ–Є –і–µ–ї–µ–љ–Є—П –Є –і–Є—Д–µ—А–µ–љ—Ж–Є—П—Ж–Є—П, —В–Њ –µ–њ–Є–≥–µ–љ–Њ–Љ—К—В –њ–Њ–і–Њ–±–љ–Њ –љ–∞ –≥–µ–љ–Њ–Љ–∞ —Й–µ —Б–µ —Г–љ–∞—Б–ї–µ–і—П–≤–∞. –Ґ–Њ–≤–∞ –±–µ –і–µ–Љ–Њ—Б—В—А–Є—А–∞–љ–Њ –≤ –µ–і–љ–∞ –љ–Њ–≤–∞ —Б—В–∞—В–Є—П –љ–∞ –Э—Г–љ–µ—Ж –Є —Б—К—В—А. –≤ —Б–њ–Є—Б–∞–љ–Є–µ—В–Њ Cell –Њ—В –∞–њ—А–Є–ї 2021, –Њ–њ–Є—Б–≤–∞—Й–∞ –Љ–µ—В–Њ–і CRISPRoff, –Ї–Њ–є—В–Њ –і–µ–є—Б—В–≤–∞ –њ–Њ —Ж–µ–ї–Є—П –≥–µ–љ–Њ–Љ, —З—А–µ–Ј —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ –±–µ–Ј –њ—А–Њ–Љ—П–љ–∞ –љ–∞ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–љ–Њ—Б—В—В–∞ –љ–∞ –Ф–Э–Ъ.
–Ц–Є–≤–µ–µ–Љ –≤ –µ–њ–Њ—Е–∞—В–∞ –љ–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–Њ—В–Њ –Є–љ–ґ–µ–љ–µ—А—Б—В–≤–Њ
–°–Ї–Њ—А–Њ —Б–ї–µ–і –≤—К–≤–µ–ґ–і–∞–љ–µ—В–Њ –љ–∞ –Љ–µ—В–Њ–і–∞ CRISPR —В–Њ–є —Б–µ –њ—А–Є–ї–∞–≥–∞ –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є—В–µ –љ–∞ –Ф–ґ–Њ–љ–∞—В–∞–љ –Т–∞–є—Б–Љ–∞–љ –Є –Ф–ґ–µ–љ–Є—Д–µ—А –Ф—Г–і–љ–∞ (–±—К–і–µ—Й–∞—В–∞ –Э–Њ–±–µ–ї–Њ–≤–∞ –ї–∞—Г—А–µ–∞—В–Ї–∞) –Ј–∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–∞ —А–µ–њ—А–µ—Б–Є—П –Є–ї–Є –∞–Ї—В–Є–≤–Є—А–∞–љ–µ –љ–∞ –Ї–Њ–љ–Ї—А–µ—В–љ–Є –≥–µ–љ–Є –≤ –њ—А–Њ–Ї–∞—А–Є–Њ—В–љ–Є –Є –µ—Г–Ї–∞—А–Є–Њ—В–љ–Є –Ї–ї–µ—В–Ї–Є. –Ш–Ј–њ–Њ–ї–Ј—Г–≤–∞ —Б–µ CRISPR –µ–љ–Ј–Є–Љ —Б –і–µ–Ј–∞–Ї—В–Є–≤–Є—А–∞–љ–∞ –љ—Г–Ї–ї–µ–∞–Ј–љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В вАУ dCas9. –Ъ—К–Љ –љ–µ–≥–Њ –Љ–Њ–≥–∞—В –і–∞ —Б–µ –Ј–∞–Ї–∞—З–≤–∞—В –і—А—Г–≥–Є –∞–Ї—В–Є–≤–љ–Є –±–µ–ї—В—К—З–љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Є, –Є–Ј–≤–µ—Б—В–љ–Є —Б —А–µ–њ—А–µ—Б–Њ—А–љ–Є—В–µ –Є–ї–Є –∞–Ї—В–Є–≤–Є—А–∞—Й–Є—В–µ —Б–Є –Ї–∞—З–µ—Б—В–≤–∞.
–Ч–∞ –њ—А–Є—Ж–µ–ї–≤–∞–љ–µ –љ–∞ –≥–µ–љ–љ–∞—В–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В –Ї—К–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Є —Г—З–∞—Б—В—К—Ж–Є –љ–∞ –≥–µ–љ–Њ–Љ–∞ CRISPR-–Ї–Њ–Љ–њ–ї–µ–Ї—Б–Є—В–µ –Є–Ј–њ–Њ–ї–Ј–≤–∞—В –Ї—К—Б–Є –≤–Њ–і–µ—Й–Є –†–Э–Ъ (guide RNA -gRNA, –і—К–ї–≥–Є 20—В–Є–љ–∞ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞), —Б –Ї–Њ–Є—В–Њ —В—К—А—Б—П—В —Б—К–Њ—В–≤–µ—В—Б—В–≤–Є–µ —Б –Ф–Э–Ъ –њ–Њ –њ—А–Њ–і—К–ї–ґ–µ–љ–Є–µ –љ–∞ –≥–µ–љ–Њ–Љ–∞. –Х–љ–Ј–Є–Љ—К—В Cas9( –≤–Є–Њ–ї–µ—В–Њ–≤–Є—П—В –Њ–≤–∞–ї) —А–∞–Ј–њ–ї–Є—В–∞ –і–≤–Њ–є–љ–∞—В–∞ —Б–њ–Є—А–∞–ї–∞ –Є —Б—А–∞–≤–љ—П–≤–∞ –Є —В—К—А—Б–Є —Б—К–≤–њ–∞–і–µ–љ–Є–µ —Б –≤–Њ–і–µ—Й–∞—В–∞ –†–Э–Ъ вАУ gRNA. –Т –Њ—А–Є–≥–Є–љ–∞–ї–љ–Є—П CRISPR CAS9 —Б—А—П–Ј–≤–∞ –і–≤–µ—В–µ –≤–µ—А–Є–≥–Є –љ–∞ –Ф–Э–Ъ –≤ –љ–∞–Љ–µ—А–µ–љ–Є—П —Г—З–∞—Б—В—К–Ї:
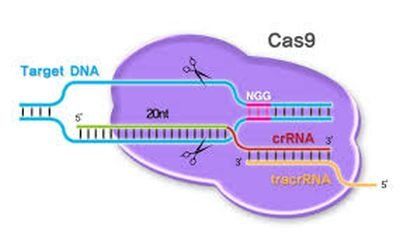 –Ъ—А–µ–і–Є—В:¬†https://www.pnabio.com/
–Ъ—А–µ–і–Є—В:¬†https://www.pnabio.com/
–Р–Ї–Њ —Б–µ –і–Њ–±–∞–≤—П—В –љ—П–Ї–Њ–ї–Ї–Њ –≤–Є–і–∞ —В–∞–Ї–Є–≤–∞ –≤–Њ–і–µ—Й–Є –†–Э–Ъ —Б —В—П—Е –Љ–Њ–ґ–µ –і–∞ —Б–µ –≤–ї–Є—П–µ –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—В–∞ –љ–∞ –љ—П–Ї–Њ–ї–Ї–Њ –≥–µ–љ–∞ –µ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ. –Ґ–∞–Ј–Є –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П —Б–µ –љ–∞—А–Є—З–∞ –Љ—Г–ї—В–Є–њ–ї–µ–Ї—Б–µ–љ CRISPR-Cas.
 |
|
–§–Є–≥ 1. –°—Е–µ–Љ–∞ –љ–∞ –Љ—Г–ї—В–Є–њ–ї–µ–Ї—Б-CRISPR —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П—В–∞ –° –µ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–∞—В–∞ –µ–Ї—Б–њ—А–µ—Б–Є—П –љ–∞ –љ—П–Ї–Њ–ї–Ї–Њ –≤–Њ–і–µ—Й–Є –†–Э–Ъ вАУ gRNA (–њ–Њ–Ї–∞–Ј–∞–љ–Є –≤ –і–Њ–ї–љ–∞—В–∞ —З–∞—Б—В –љ–∞ —Д–Є–≥—Г—А–∞—В–∞, CRISPR-(–ґ—К–ї—В–Є –µ–ї–Є–њ—Б–Є) –Љ–Њ–ґ–µ –і–∞ –≤–ї–Є—П–µ –љ–∞ –≥–µ–љ–љ–∞—В–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В –љ–∞ –њ–Њ—А–µ–і–Є—Ж–∞ –Њ—В –≥–µ–љ–Є –≤ –µ–і–љ–∞ –Ї–ї–µ—В–Ї–∞ –Ї–∞—В–Њ –†–µ–і–∞–Ї—В–Є—А–∞–љ–µ—В–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞ —Б–Ї—К—Б–≤–∞–љ–µ –љ–∞ –і–≤—Г–≤–µ—А–Є–ґ–љ–∞—В–∞ –Ф–Э–Ъ, –Ї–Њ–µ—В–Њ —Б–µ –њ–Њ–њ—А–∞–≤—П —Б –Ї–ї–µ—В—К—З–љ–Є—В–µ –Ф–Э–Ъ-—А–µ–њ–∞—А–Є—А–∞—Й–Є –µ–љ–Ј–Є–Љ–Є. –†–µ–≥—Г–ї–∞—Ж–Є—П –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—П—В–∞ —Б–µ –Њ—Б—К—Й–µ—Б—В—П–≤–∞ —З—А–µ–Ј –љ–∞—Б–Њ—З–≤–∞–љ–µ –љ–∞ –Є–љ–∞–Ї—В–Є–≤–Є—А–∞–љ –µ–љ–Ј–Є–Љ Cas9 –љ–∞—Б–Њ—З–µ–љ —Б –≤–Њ–і–µ—Й–Є—В–µ –†–Э–Ъ –Ї—К–Љ –Ф–Э–Ъ-–Њ–±–ї–∞—Б—В–Є –њ—А–µ–і–Є –Є–ї–Є —Б–ї–µ–і –љ–∞—З–∞–ї–Њ—В–Њ –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—П, –Ї—К–і–µ—В–Њ –Є–ї–Є –њ—А–µ—З–Є –љ–∞ —А–∞–±–Њ—В–∞—В–∞ –љ–∞ –†–Э–Ъ-–њ–Њ–ї–Є–Љ–µ—А–∞–Ј–∞—В–∞, –Є–ї–Є –њ—А–Є–≤–ї–Є—З–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ–Є —Д–∞–Ї—В–Њ—А–Є (—З—А–µ–Ј –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ —Б–≤—К—А–Ј–∞–љ–Є –Ї—К–Љ Cas –µ—Д–µ–Ї—В–Њ—А–љ–Є –±–µ–ї—В—К—З–љ–Є —Д—А–∞–≥–Љ–µ–љ—В–Є - –Ј–µ–ї–µ–љ–Є—В–µ –Є –Њ—А–∞–љ–ґ–µ–≤–Є —Ж–Є–ї–Є–љ–і—А–Є –љ–∞ —Д–Є–≥.1), –Ї–Њ–Є—В–Њ –і–µ–є—Б—В–≤–∞—В —Б—В–Є–Љ—Г–ї–Є—А–∞—Й–Њ –Є–ї–Є —А–µ–њ—А–µ—Б–Є—А–∞—Й–Њ –≤—К—А—Е—Г —Ж–µ–ї–µ–≤–Є—П –≥–µ–љ. –§–Є–≥. –њ–Њ McCarty, N.S., Graham, A.E., Studen√°, L.¬†et al.¬†Multiplexed CRISPR technologies for gene editing and transcriptional regulation.¬†Nat Commun¬†11,¬†1281 (2020). https://doi.org/10.1038/s41467-020-15053-x |
–Ш–Ј–њ–Њ–ї–Ј—Г–≤–∞–љ–µ—В–Њ –љ–∞ –і–µ–Ј–∞–Ї—В–Є–≤–Є—А–∞–љ –µ–љ–Ј–Є–Љ CRISPR вАУ dCAS9 –Љ–Њ–і–Є—Д–Є—Ж–Є—А–∞ —В–µ—Е–љ–Є–Ї–∞—В–∞ CRISPR –Њ—В –≥–µ–љ–Њ–Љ–љ–Њ –≤ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–Њ —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ.
–Т —Б—В–∞—В–Є—П—В–∞ –љ–∞ –Э—Г–љ–µ—Ж –Є —Б—К–∞–≤—В. —Б–µ –Њ–њ–Є—Б–≤–∞ –љ–∞—З–Є–љ –Ј–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–∞ —А–µ–і–∞–Ї—Ж–Є—П –њ–Њ –њ—А–Њ–і—К–ї–ґ–µ–љ–Є–µ –љ–∞ —Ж–µ–ї–Є—П –≥–µ–љ–Њ–Љ –Ї–∞—В–Њ —Б–µ —Г—Б—В–∞–љ–Њ–≤–Є –Њ–±—А–∞—В–Є–Љ–Њ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ–∞ —В–Є—И–Є–љ–∞, –Ї–Њ—П—В–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П—В–∞ –њ–Њ–Љ–љ—П—В —Б–ї–µ–і –њ–Њ—А–µ–і–љ–Є—В–µ –Ї–ї–µ—В—К—З–љ–Є –і–µ–ї–µ–љ–Є—П.
–Ґ–µ—А–Љ–Є–љ—К—В вАЮ–Х–њ–Є–≥–µ–љ–Њ–Љ–љ–∞ —А–µ–і–∞–Ї—Ж–Є—ПвАЬ –њ–Њ–і—З–µ—А—В–∞–≤–∞, —З–µ –љ–µ —Б–µ –Љ–µ–љ–Є –≥–µ–љ–µ—В–Є—З–љ–Є—П –Ї–Њ–і, –∞ —Б–∞–Љ–Њ –љ–∞—З–Є–љ–∞, –њ–Њ –Ї–Њ–є—В–Њ —В–Њ–є —Б–µ —З–µ—В–µ –Є –Є–љ—В–µ—А–њ–µ—В–Є—А–∞. –Ч–∞ —А–µ–њ—А–µ—Б–Є—П —Б–µ –Є–Ј–њ–Њ–ї–Ј—Г–≤–∞ –Ј–∞–Ї–∞—З–≤–∞–љ–µ –љ–∞ –Љ–µ—В–Є–ї–љ–∞ –≥—А—Г–њ–Є –Ї—К–Љ –љ—Г–Ї–ї–µ–Њ—В–Є–і–Є—В–µ. –Ш–Ј–≤–µ—Б—В–љ–Њ –µ, —З–µ —В–Њ–≤–∞ –Љ–µ—В–Є–ї–Є—А–∞–љ–µ —Б–µ –Ј–∞–њ–∞–Ј–≤–∞ –њ—А–Є —А–µ–њ–ї–Є–Ї–∞—Ж–Є—П –љ–∞ –Ф–Э–Ъ. –†–Њ–і–Є—В–µ–ї—Б–Ї–Є—В–µ –≤–µ—А–Є–≥–Є, –љ–Њ—Б–µ—Й–Є –Љ–µ—В–Є–ї–Є—А–∞–љ–Є—В–µ –љ—Г–Ї–ї–µ—В–Є–і–Є –Є–љ—Б—В—А—Г–Ї—В–Є—А–∞—В –Љ–µ—В–Є–ї–Є—А–∞–љ–µ—В–Њ –Є –љ–∞ –љ–Њ–≤–Њ—Б–Є–љ—В–µ–Ј–Є—А–∞–љ–Є—В–µ –і—К—Й–µ—А–љ–Є –≤–µ—А–Є–≥–Є –≤ —Б—К—Й–Є—В–µ –Њ–±–ї–∞—Б—В–Є –Њ—В –Ф–Э–Ъ.
–Ф–Њ—Б–Ї–Њ—А–Њ —Б–µ —Б–Љ—П—В–∞—И–µ, —З–µ —Б–∞–Љ–Њ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–љ–Њ—Б—В–Є –Њ—В –Ф–Э–Ъ —Б—К–і—К—А–ґ–∞—Й–Є CpG (—Ж–Є—В–Њ–Ј–Є–љ/–≥—Г–∞–љ–Є–љ) –Љ–Њ–≥–∞—В –і–∞ –±—К–і–∞—В –Љ–µ—В–Є–ї–Є—А–∞–љ–Є. –Р–Ї–Њ —Б–µ –Љ–µ—В–Є–ї–Є—А–∞ –Ф–Э–Ъ —В–Њ–≤–∞ –њ–Њ–Љ–∞–≥–∞ –Ј–∞ –њ–Њ—В–Є—Б–Ї–∞–љ–µ –љ–∞ –≥–µ–љ–љ–∞—В–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В –≤ –Љ–µ—В–Є–ї–Є—А–∞–љ–Є—В–µ –Љ–µ—Б—В–∞. –Э–Њ —Б –љ–Њ–≤–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б CRISPRoff —А–∞–Ј—А–∞–±–Њ—В–µ–љ –Њ—В –Э—Г–љ–µ—Ж –Є —Б—К–∞–≤—В. –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є—Вe –љ–∞ –Ф–ґ–Њ–љ–∞—В–∞–љ –Т–∞–є—Б–Љ–∞–љ –Є –Ы—О–Ї –Ф–ґ–Є–ї–±—К—А—В, –Њ—В –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –љ–∞ –Ъ–∞–ї–Є—Д–Њ—А–љ–Є—П –Є –£–∞–є—В—Е–µ–і –Ш–љ—Б—В–Є—В—Г—В–∞ –≤ –Ь–∞—Б–∞—З—Г–Ј–µ—В—Б, –Љ–µ—В–Є–ї–Є—А–∞–љ–µ—В–Њ –Љ–Њ–ґ–µ –і–∞ —Б–µ —А–∞–Ј–њ—А–Њ—Б—В–Є—А–∞ –њ–Њ —Ж–µ–ї–Є—П –≥–µ–љ–Њ–Љ –Є —В–∞–Ї–∞ –Ј–љ–∞—З–Є—В–µ–ї–љ–Њ —Б–µ –њ–Њ—В—Г—И–∞–≤–∞ –≥–µ–љ–љ–∞—В–∞ –µ–Ї—Б–њ—А–µ—Б–Є—П –љ–µ —Б–∞–Љ–Њ –≤ CpG –Њ–±–ї–∞—Б—В–Є—В–µ. –Ґ–Њ–≤–∞ —Б—В–∞–≤–∞ –±–µ–Ј –і–∞ —Б–µ –њ—А–Њ–Љ–µ–љ—П —Б–∞–Љ–Є—П –≥–µ–љ–µ—В–Є—З–µ–љ –Ї–Њ–і.
–Ф–Њ—Б–µ–≥–∞ –µ–њ–Є–≥–µ–љ–µ—В–Є—З–љ–Њ—В–Њ —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—И–µ –њ–Њ—Б—В–Њ—П–љ–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –љ–∞ –Є–Ј–Ї—Г—Б—В–≤–µ–љ–Є—В–µ –±–µ–ї—В—К—Ж–Є —А–µ–≥—Г–ї–Є—А–∞—Й–Є –≥–µ–љ–љ–∞—В–∞ –µ–Ї—Б–њ—А–µ—Б–Є—П, –Ї–Њ–Є—В–Њ –љ–µ —Б–µ —Г–љ–∞—Б–ї–µ–і—П–≤–∞—В –њ—А–Є –Ї–ї–µ—В—К—З–љ–Є—В–µ –і–µ–ї–µ–љ–Є—П. –° –љ–Њ–≤–Є—П –њ–Њ–і—Е–Њ–і –µ –і–Њ—Б—В–∞—В—К—З–љ–Њ —Б–∞–Љ–Њ –≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ..
–Х–њ–Є–≥–µ–љ–Њ–Љ–љ–Њ—В–Њ —А–µ–і–∞–Ї—В–Є—А–∞–љ–µ –µ –љ–∞–њ—К–ї–љ–Њ –Њ–±—А–∞—В–Є–Љ–Њ —Б –њ–Њ–Љ–Њ—Й—В–∞ –љ–∞ –њ–∞—А–∞–ї–µ–ї–љ–Њ –Ї–Њ–љ—Б—В—А—Г–Є—А–∞–љ–Є—П –Њ—В —Б—К—Й–∞—В–∞ –≥—А—Г–њ–∞ —Г—З–µ–љ–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б вАУ CRISPRon, –Ї–Њ–є—В–Њ –њ—А–µ–Љ–∞—Е–≤–∞/–Є–Ј—В—А–Є–≤–∞ –Љ–µ—В–Є–ї–Њ–≤–Є—В–µ –Љ–∞—А–Ї–µ—А–Є –Њ—В –Ф–Э–Ъ.
 |
|
(–§–Є–≥. 2 –µ –Њ—В Moussa HF... Cell, Volume 184, 29 April 2021, Pages 2281-2283) CRISPRoff: –Я—А–Њ–≥—А–∞–Љ–Є—А—Г–µ–Љ–Є—П—В –Ј–∞–њ–Є—Б–≤–∞—З –љ–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–∞ –њ–∞–Љ–µ—В —Б–µ —Б—К—Б—В–Њ–Є –Њ—В –µ–і–Є–љ –Ї–∞—В–∞–ї–Є—В–Є—З–љ–Њ –љ–µ–∞–Ї—В–Є–≤–µ–љ CRISPR –±–µ–ї—В—К–Ї - dCAS9, –Ї–Њ–є—В–Њ –Љ–Њ–ґ–µ –і–∞ —Г—Б—В–∞–љ–Њ–≤–Є —Г–ї—В—А–∞-—Б—В–∞–±–Є–ї–љ–Њ –Є —Г–љ–∞—Б–ї–µ–і—П–µ–Љ–Њ –Ј–∞–≥–ї—Г—И–∞–≤–∞–љ–µ –љ–∞ –≥–µ–љ–Є—В–µ. (–Р) –Э—Г–љ–µ—Ж –Є —Б—К–∞–≤—В.(2021) –Ї–Њ–љ—Б—В—А—Г–Є—А–∞—В –Љ–љ–Њ–≥–Њ–±–µ–ї—В—К—З–µ–љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б CRISPRoff, –≤ –Ї–Њ–є—В–Њ dCas9 –µ —Б–≤—К—А–Ј–∞–љ –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ —Б –µ—Д–µ–Ї—В–Њ—А–љ–Є—В–µ –Њ–±–ї–∞—Б—В–Є –љ–∞ –±–µ–ї—В—К—Ж–Є—В–µ KRAB (—В–Њ–є –њ–Њ–Љ–∞–≥–∞ –љ–∞ —Е–Є—Б—В–Њ–љ- –Љ–Њ–і–Є—Д–Є—Ж–Є—А–∞—Й–Є—В–µ —Д–∞–Ї—В–Њ—А–Є), Dnmt3A –Є Dnmt3L (–Ф–Э–Ъ-–Љ–µ—В–Є–ї–Є—А–∞—Й–Є –µ–љ–Ј–Є–Љ–Є). –Т—А–µ–Љ–µ–љ–љ–∞—В–∞ –µ–Ї—Б–њ—А–µ—Б–Є—П –љ–∞ —Б—К—Б—В–∞–≤–љ–Є—П –±–µ–ї—В—К–Ї CRISPRoff –њ—А–µ–і–Є–Ј–≤–Є–Ї–≤–∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ –Љ–µ—В–Є–ї–Є—А–∞–љ–µ –љ–∞ —Е–Є—Б—В–Њ–љ–∞ (H3K9) –Є –љ–∞ –љ—Г–Ї–ї–µ–Њ—В–Є–і–Є—В–µ –љ–∞ –Ф–Э–Ъ, –Є —Б —В–Њ–≤–∞ –і–Њ–≤–µ–ґ–і–∞ –і–Њ –Љ–љ–Њ–≥–Њ —Б—В–∞–±–Є–ї–љ–Њ –Ј–∞–≥–ї—Г—И–∞–≤–∞–љ–µ –љ–∞ –≥–µ–љ–Є—В–µ –≤ –њ—А–Њ–і—К–ї–ґ–µ–љ–Є–µ –љ–∞ –њ–Њ–≤–µ—З–µ –Њ—В 450 –Ї–ї–µ—В—К—З–љ–Є –і–µ–ї–µ–љ–Є—П –Є –≤ 80-90% –Њ—В –Ї–ї–µ—В—К—З–љ–∞—В–∞ –њ–Њ–њ—Г–ї–∞—Ж–Є—П. –Ч–∞–≥–ї—Г—И–∞–≤–∞–љ–µ—В–Њ —З—А–µ–Ј CRISPRoff –µ –Њ–±—А–∞—В–Є–Љ–Њ —З—А–µ–Ј –µ–Ї—Б–њ—А–µ—Б–Є—П –љ–∞ —Б—К—Б—В–∞–≤–љ–Є—П –±–µ–ї—В—К–Ї CRISPRon вАУ –Є–Ј—В—А–Є–≤–∞—З –љ–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–∞—В–∞ –њ–∞–Љ–µ—В: –Ї—К–Љ dCas9 —Б–∞ –њ—А–Є–Ї–∞—З–µ–љ–Є –љ—П–Ї–Њ–ї–Ї–Њ –∞–Ї—В–Є–≤–љ–Є –±–µ–ї—В—К–Ї–∞ - –Ф–Э–Ъ –і–µ–Љ–µ—В–Є–ї–∞–Ј–∞—В–∞ TET1 (–Ї–Њ—П—В–Њ –њ—А–µ–Љ–∞—Е–≤–∞ –Љ–µ—В–Є–ї–љ–Є—В–µ –≥—А—Г–њ–Є вАЮ–Ј–∞–њ–Є—Б–∞–љ–ЄвАЬ –њ—А–µ–і–Є —В–Њ–≤–∞ –Њ—В CRISPRfoff) –Є —А–∞–Ј–ї–Є—З–љ–Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ–Є –∞–Ї—В–Є–≤–∞—В–Њ—А–Є (VP64, p65, Rta). –Ґ–∞–Ї–∞ –Њ—Б–≤–µ–љ –Є–Ј—В—А–Є–≤–∞–љ–µ –љ–∞ вАЮ–Љ–µ—В–Є–ї–љ–Њ—В–ЊвАЬ –Ј–∞–≥–ї—Г—И–∞–≤–∞–љ–µ —Б–µ —Аe–∞–Ї—В–Є–≤–Є—А–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—П—В–∞ –≤—К—А—Е—Г —Г—З–∞—Б—В—К—Ж–Є—В–µ, –≤ –Ї–Њ–Є—В–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—К—В –µ вАЮ–њ—А–Є—Ж–µ–ї–µ–љвАЬ –Њ—В –≤–Њ–і–µ—Й–Є—В–µ –†–Э–Ъ (guide gRNA). –Ъ—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Є–ї–∞–≥–∞–љ–µ –љ–∞ CRISPRon e –і–Њ—Б—В–∞—В—К—З–љ–Њ –Ј–∞ –і–∞ —Б–µ –Є–Ј—В—А–Є–µ —А–µ–њ—А–µ—Б–Є—А–∞—Й–Њ—В–Њ –Љ–µ—В–Є–ї–Є—А–∞–љ–µ. –Ґ–∞–Ї–∞ —З–µ CRISPRoff/CRISPRon —Б–Є—Б—В–µ–Љ–∞—В–∞ –µ —Б–њ–µ—Ж–Є—Д–Є—З–µ–љ –µ–њ–Є–≥–µ–љ–µ–љ –њ—А–µ–≤–Ї–ї—О—З–≤–∞—В–µ–ї –љ–∞ –≥–µ–љ–љ–∞—В–∞ –µ–Ї—Б–њ—А–µ—Б–Є—П. –Ґ–µ–Ј–Є —Б–≤—К—А–Ј–∞–љ–Є –њ–Њ–Љ–µ–ґ–і—Г —Б–Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ–Є –∞–Ї—В–Є–≤–∞—В–Њ—А–Є - VP64, p65, Rta (–Њ–Ј–љ–∞—З–µ–љ–Є —Б —В—А–Є—В–µ —В—А–Є—К–≥—К–ї–љ–Є—З–µ—В–∞ –≤ –≥–Њ—А–љ–∞—В–∞ —З–∞—Б—В –љ–∞ —Д–Є–≥.1(–Р)) –Љ–Њ–≥–∞—В –і–∞ —Б–µ –і–Њ—Б—В–∞–≤—П—В –Є –±–µ–Ј –і–∞ —Б–∞ –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ —Б–≤—К—А–Ј–∞–љ–Є —Б dCas9. –Т–Љ–µ—Б—В–Њ —В–Њ–≤–∞ –Ї—К–Љ —В—П—Е –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ –µ —Б–≤—К—А–Јa–љ –±–µ–ї—В—К–Ї–∞ MS2CP (–Є–Ј–≤–µ—Б—В–µ–љ —Б —В–Њ–≤–∞ —З–µ —Г—З–∞—Б—В–≤–∞ –≤ –Њ–±–≤–Є–≤–Ї–∞—В–∞ –љ–∞ –±–∞–Ї—В–µ—А–Є–Њ—Д–∞–≥–∞ MS2). –С–µ–ї—В—К–Ї—К—В MS2CP –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ —Б –≤–Њ–і–µ—Й–∞—В–∞ –†–Э–Ъ, –Ї—К–Љ –Ї–Њ—П—В–Њ –µ –і–Њ–±–∞–≤–µ–љ–∞ –µ–і–љ–∞ –†–Э–Ъ-–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–љ–Њ—Б—В MS2 (–љ–∞–Љ–µ—А–µ—В–µ –Љ–∞–ї–Ї–∞—В–∞ –±—А–Є–Љk–∞-—Д–Є–±–Є—З–Ї–∞ –љ–∞ gRNA, —Б—В—К—А—З–∞—Й–∞ –Є–Ј–≤—К–љ dCAS9 –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞. T—П –Њ—Б–Є–≥—Г—А—П–≤–∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ –†–Э–Ъ-–±–µ–ї—В—К—З–љ–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ - –≤–ґ. –њ–Њ–ї—Г–Љ–µ—Б–µ—З–Є–љ–Ї–∞—В–∞, –Ї–Њ—П—В–Њ –µ —Б–≤—К—А–Ј–∞–љ–∞ —Б —В—А–Є—К–≥—К–ї–љ–Є—З–µ—В–∞—В–∞ –љ–∞ —Д–Є–≥.1–Р –≤–і—П—Б–љ–Њ –≥–Њ—А–µ). –Ґ–∞–Ї–∞, –≤–Њ–і–µ–љ –Њ—В gRNA, MCP e –њ—А–Є—Ж–µ–ї–µ–љ –Њ—В dCas9 –і–Њ —В–Њ—З–љ–Њ—В–Њ –Љ—П—Б—В–Њ –≤ –≥–µ–љ–Њ–Љ–∞ , –љ–∞–њ—А–Є–Љ–µ—А –±–ї–Є–Ј–Њ –і–Њ —В—А–∞–љ—Б–Ї—А–Є–Њ–њ—Ж–Є–Њ–љ–љ–Њ –љ–∞—З–∞–ї–Њ, –∞ —Б –ЬS2CP —В–∞–Љ –Њ—В–Є–≤–∞—В –Є –Ј–∞–Ї–∞—З–µ–љ–Є—В–µ –Ї—К–Љ –љ–µ–≥–Њ –∞–Ї—В–Є–≤–Є—А–∞—Й–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Є VP64, p65, Rta. (B) –Ч–∞–њ–Є—Б–∞–љ–Њ—В–Њ –Њ—В CRISPRoff —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ –≥–µ–љ–љ–Њ –Ј–∞–≥–ї—Г—И–∞–≤–∞–љ–µ –µ —Б—В–∞–±–Є–ї–љ–Њ –Є –Њ—Ж–µ–ї—П–≤–∞ –њ—А–Є –Ї–ї–µ—В—К—З–љ–∞ –і–Є—Д–µ–љ—Ж–Є—П—Ж–Є—П –љ–∞ –Є–љ–і—Г—Ж–Є—А–∞–љ–Є –њ–ї—Г—А–Є–њ–Њ—В–µ–љ—В–љ–Є –Ї–ї–µ—В–Ї–Є (iPSCs) –≤ –љ–µ–≤—А–Њ–љ–Є. –Х–њ–Є–≥–µ–љ–µ—В–Є—З–љ–∞—В–∞ —А–µ–њ—А–µ—Б–Є—П(–Ј–∞–≥–ї—Г—И–∞–≤–∞–љ–µ) —Б–µ –Ј–∞–њ–∞–Ј–≤–∞ –≤ –і–Є—Д–µ—А–µ–љ—Ж–Є—А–∞–љ–Є—В–µ –љ–µ–≤—А–Њ–љ–Є –Є –њ—А–µ—З–Є –љ–∞ —А–∞–±–Њ—В–∞—В–∞ –љ–∞ –µ–і–Є–љ –≥–µ–љ, —Б–≤—К—А–Ј–∞–љ —Б –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–љ–Њ –Ј–∞–±–Њ–ї—П–≤–∞–љ–µ. (C) –Я—А–µ–і–Є–Љ—Б—В–≤–∞ –љ–∞ CRISPRoff —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П—В–∞: |
–Ґ–µ—А–∞–њ–µ–≤—В–Є—З–љ–Є—П—В –њ–Њ—В–µ–љ—Ж–Є–∞–ї –љ–∞ CRISPRoff
–Я—А–Є –≤—Б–µ —З–µ –≥–µ–љ–љ–∞—В–∞ –Є –Ї–ї–µ—В—К—З–љ–∞ —В–µ—А–∞–њ–Є—П —Б–∞ –±—К–і–µ—Й–µ—В–Њ –љ–∞ –Љ–µ–і–Є—Ж–Є–љ–∞—В–∞ –Ї—К–Љ —В—П—Е –Є–Љ–∞ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–љ–∞ —А–µ–Ј–µ—А–≤–Є—А–∞–љ–Њ—Б—В, —В—М–є –Ї–∞—В–Њ —В–µ–Ј–Є –Љ–µ—В–Њ–і–Є –≤–Ї–ї—О—З–≤–∞—В –њ–µ—А–Љ–∞–љ–µ–љ—В–љ–∞ –њ—А–Њ–Љ—П–љ–∞ –љ–∞ –≥–µ–љ–Њ–Љ–∞. –Ч–∞—В–Њ–≤–∞ –љ–Є–µ —Б–µ –Њ–њ–Є—В–≤–∞–Љ–µ –і–∞ –љ–∞–Љ–µ—А–Є–Љ –і—А—Г–≥–Є –њ—К—В–Є—Й–∞, –Є–Ј–њ–Њ–ї–Ј—Г–≤–∞–є–Ї–Є CRISPR, –Ј–∞ –і–∞ —В—А–µ—В–Є—А–∞–Љ–µ –±–Њ–ї–µ—Б—В–Є—В–µ вАУ –Ї–∞–Ј–≤–∞ –Ы—О–Ї –Ф–ґ–Є–ї–±—К—А—В, –µ–і–Є–љ –Њ—В –≥–ї–∞–≤–љ–Є—В–µ —Б—К–∞–≤—В–Њ—А–Є –љ–∞ —Б—В–∞—В–Є—П—В–∞.
–Р–Ї–Њ –њ—А–Є—Ж–µ–ї—К—В –Ј–∞ –Љ–µ—В–Є–ї–Є—А–∞–љ–µ –µ —Б–∞–Љ–Њ –≥–µ–љ–∞ MAPT, –Ї–Њ–є—В–Њ –Ї–Њ–і–Є—А–∞ –±–µ–ї—В—К–Ї–∞ Tau, —Б–≤—К—А–Ј–∞–љ —Б –±–Њ–ї–µ—Б—В—В–∞ –љ–∞ –Р–ї—Ж—Е–∞–є–Љ–µ—А, CRISPoff –љ–∞–Љ–∞–ї—П–≤–∞ —Б 90% –µ–Ї—Б–њ—А–µ—Б–Є—П—В–∞ –Љ—Г. –Ъ–Њ–≥–∞—В–Њ —В–Њ–≤–∞ —Б–µ –љ–∞–њ—А–∞–≤–Є –≤ —Б—В–≤–Њ–ї–Њ–≤–Є –Ї–ї–µ—В–Ї–Є, —Б–ї–µ–і —Е–Є–Љ–Є—З–љ–∞—В–∞ –Є–Љ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—П –≤ –љ–µ–≤—А–Њ–љ–Є –≥–µ–љ—К—В –њ—А–Њ–і—К–ї–ґ–∞–≤–∞ –і–∞ –µ –њ–Њ—В–Є—Б–љ–∞—В. –Ґ–∞–Ї–∞ —Б–µ –њ–Њ–Ї–∞–Ј–≤–∞, —З–µ –Є–Љ–∞ –µ–њ–Є–≥–µ–љ–љ–Њ —Г–љ–∞—Б–ї–µ–і—П–≤–∞–љ–µ, –Ї–∞—В–Њ –љ–Њ–≤ –≤–Є–і –Ї–ї–µ—В—К—З–љ–∞ –њ–∞–Љ–µ—В. –Я–Њ–і—З–µ—А—В–∞–≤–∞–є–Ї–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–љ–Є—В–µ –≤—К–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –љ–∞ —В–Њ–Ј–Є –њ–Њ–і—Е–Њ–і, –њ—А–Њ—Д. –Т–∞–є—Б–Љ–∞–љ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–≤–∞, —З–µ –њ—А–Є–ї–∞–≥–∞–љ–µ—В–Њ –Љ—Г –Є–љ –≤–Є–≤–Њ –љ—П–Љ–∞ –і–∞ –µ –ї–µ—Б–љ–Њ. –Ъ–∞–Ї –і–∞ —Б–µ –Њ—Б—К—Й–µ—Б—В–≤–Є –і–Њ—Б—В–∞–≤–Ї–∞—В–∞ –љ–∞ CRISPRoff –≤ –µ–і–Є–љ –≤—К–Ј—А–∞—Б—В–µ–љ –Њ—А–≥–∞–љ–Є–Ј—К–Љ –Є —Й–µ –±—К–і–µ –ї–Є –і–Њ—Б—В–∞—В—К—З–љ–Њ –і–∞ —Б–µ –њ–Њ–≤–ї–Є—П–µ –љ–∞ –Ј–∞–±–Њ–ї—П–≤–∞–љ–µ—В–Њ –љ–∞ –Р–ї—Ж—Е–∞–є–Љ–µ—А?
–Х–њ–Є–≥–µ–љ–µ—В–Є—З–љ–Є—В–µ —А–µ–і–∞–Ї—В–Њ—А–Є –Ї–∞—В–Њ CRISPRoff –Є–Љ–∞—В –≥–Њ–ї—П–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ–љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї, –љ–∞–є-–≤–µ—З–µ –Ј–∞—Й–Њ—В–Њ –Ј–∞–њ–∞–Љ–µ—В—П–≤–∞—В –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–Њ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—В–∞ –љ–µ —Б–∞–Љ–Њ –≤ —В—А–µ—В–Є—А–∞–љ–Є—В–µ –Ї–ї–µ—В–Ї–Є, –љ–Њ –Є —Б–ї–µ–і 450 –Ї–ї–µ—В—К—З–љ–Є –і–µ–ї–µ–љ–Є—П. –Ш–Ј–љ–µ–љ–∞–і–≤–∞—Й–Њ –µ, —З–µ –і–∞–ґ–µ –≤ —Б—В–≤–Њ–ї–Њ–≤–Є –Ї–ї–µ—В–Ї–Є, –Ї–Њ–Є—В–Њ –њ—А–µ–Љ–Є–љ–∞–≤–∞—В –њ—А–µ–Ј –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Є —А–µ–њ—А–Њ–≥—А–∞–Љ–Є—А–∞–љ–Є—П –љ–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–∞, –Љ–µ—В–Є–ї–Є—А–∞–љ–Є—В–µ –Њ—В CRISPRoff –Љ–µ—Б—В–∞ —Б–µ –Ј–∞–њ–∞–Ј–≤–∞—В –≤ –Ј–љ–∞—З–Є—В–µ–ї–љ–∞ —З–∞—Б—В –Њ—В –Ї–ї–µ—В–Ї–Є—В–µ. –Ґ–µ–Ј–Є –љ–∞—Е–Њ–і–Ї–Є –њ–Њ–Ї–∞–Ј–≤–∞—В, —З–µ –і—К–ї–≥–Њ–ґ–Є–≤—Г—Й —В–µ—А–∞–њ–µ–≤—В–Є—З–µ–љ –µ—Д–µ–Ї—В —Б–µ –њ–Њ–ї—Г—З–∞–≤–∞ —Б–ї–µ–і –µ–і–љ–Њ–Ї—А–∞—В–љ–Њ –њ—А–Є–ї–∞–≥–∞–љ–µ –љ–∞ CRISPRoff, –Ї–Њ–µ—В–Њ –µ –Љ–љ–Њ–≥–Њ –Њ–±–љ–∞–і–µ–ґ–і–∞–≤–∞—Й–Њ –њ—А–Є —В—А–µ—В–Є—А–∞–љ–µ –љ–∞ —А–µ–і–Ї–Є –≥–µ–љ–µ—В–Є—З–љ–Є –і–µ—Д–µ–Ї—В–Є вАУ –Ї–∞—В–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Ь–∞—А—Д–∞–љ, –Ј–∞—Б—П–≥–∞—Й —Б—К–µ–і–Є–љ–Є—В–µ–ї–љ–∞—В–∞ —В—К–Ї–∞–љ, Job —Б–Є–љ–і—А–Њ–Љ–∞ (–і–µ—Д–µ–Ї—В –љ–∞ –Є–Љ—Г–љ–љ–∞—В–∞ —Б–Є—Б—В–µ–Љ–∞) –Є –љ—П–Ї–Њ–Є —Д–Њ—А–Љ–Є –љ–∞ —А–∞–Ї, —Б–≤—К—А–Ј–∞–љ–Є —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—В–∞ –љ–∞ –µ–і–љ–Њ –њ–Њ–≤—А–µ–і–µ–љ–Њ –Ї–Њ–њ–Є–µ –љ–∞ –≥–µ–љ–∞.
–Ь–µ—В–Њ–і—К—В CRISPRoff –њ—А–µ–і–ї–∞–≥–∞ –µ—Д–µ–Ї—В–Є–≤–љ–∞, —Б–њ–µ—Ж–Є—Д–Є—З–љ–∞ –≤—К–Ј–Љ–Њ–ґ–љ–Њ—Б—В –Ј–∞ –Љ–∞–љ–Є–њ—Г–ї–∞—Ж–Є—П –љ–∞ –µ–њ–Є–≥–µ–љ–Њ–Љ–љ–∞—В–∞ –њ–∞–Љ–µ—В. –Ґ–Њ–є –њ–Њ–Ј–≤–Њ–ї—П–≤–∞ –Љ–љ–Њ–≥–Њ –љ–∞—Г—З–љ–Є –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–љ–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –≤—К–≤ –≤—Б—П–Ї–∞–Ї–≤–Є –≤–Є–і–Њ–≤–µ –ґ–Є–≤–Њ—В–Є–љ—Б–Ї–Є –Ї–ї–µ—В–Ї–Є .
–Ш–Ј—В–Њ—З–љ–Є–Ї: https://www.bionews.org.uk/page_155920¬†–Є –≤
–Ю—А–Є–≥–Є–љ–∞–ї–љ–∞—В–∞ —Б—В–∞—В–Є—П: вАЬGenome-wide programmable transcriptional memory by CRISPR-based epigenome editingвАЭ by James K. Nu√±ez, вА¶..Luke A. Gilbert and Jonathan S. Weissman, 9 April 2021,¬†Cell. DOI: 10.1016/j.cell.2021.03.025
–†–µ–Ј—О–Љ–Є—А–∞–љ–∞ –≤ Moussa HF... Cell, ,Volume 184, 29 April 2021, Pages 2281-2283 вАЬHere to stay: Writing lasting epigenetic memoriesвАЭ doi.org/10.1016/j.cell.2021.04.007
–Я–Њ–њ—Г–ї—П—А–љ–Њ –Њ–±—П—Б–љ–µ–љ–Є–µ - 14 –Љ–Є–љ –≤–Є–і–µ–Њ–Ї–ї–Є–њ:¬†
–Р–≤—В–Њ—А—К—В –Ъ–Њ–љ—Б—В–∞–љ—В–Є–љ –І–Є–њ–µ–≤ –µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–µ–љ –Є –Ї–ї–µ—В—К—З–µ–љ –±–Є–Њ–ї–Њ–≥ –Њ—В –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –°—В–Њ–љ–Є –С—А—Г–Ї –≤ –Э—О –Щ–Њ—А–Ї.
–Ю—Й–µ –њ–Њ —В–µ–Љ–∞—В–∞

–Ц–Є–≤–Њ—В—К—В
–Ь–Є—Б—В–µ—А–Є—П—В–∞ –Њ–Ї–Њ–ї–Њ –±–ї–Є–Ј–љ–∞—Ж–Є—В–µ

–Ц–Є–≤–Њ—В—К—В
–£—З–µ–љ–Є —А–∞–Ј—А–∞–±–Њ—В–Є—Е–∞ –љ–Њ–≤–∞ —Б—В—А–∞—В–µ–≥–Є—П –Ј–∞ –≥–µ–љ–љ–∞ —В–µ—А–∞–њ–Є—П –Ј–∞ –Ј–∞–±–∞–≤—П–љ–µ –љ–∞ —Б—В–∞—А–µ–µ–љ–µ—В–Њ
–Ц–Є–≤–Њ—В—К—В
–Э–Њ–≤ —В–µ—Б—В –Ј–∞ COVID-19, –±–∞–Ј–Є—А–∞–љ –љ–∞ CRISPR, –Є–Ј–њ–Њ–ї–Ј–≤–∞ –Ї–∞–Љ–µ—А–∞ –љ–∞ —Б–Љ–∞—А—В—Д–Њ–љ















–Ъ–Њ–Љ–µ–љ—В–∞—А–Є
–Ь–Њ–ї—П, —А–µ–≥–Є—Б—В—А–Є—А–∞–є—В–µ —Б–µ –Њ—В T–£–Ъ!
–Р–Ї–Њ –≤–µ—З–µ –Є–Љ–∞—В–µ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—П, –љ–∞—В–Є—Б–љ–µ—В–µ –Ґ–£–Ъ!
–Э—П–Љ–∞ –Ї–Њ–Љ–µ–љ—В–∞—А–Є –Ї—К–Љ —В–∞–Ј–Є –љ–Њ–≤–Є–љ–∞ !
–Я–Њ—Б–ї–µ–і–љ–Є –Ї–Њ–Љ–µ–љ—В–∞—А–Є
Gunteer
–Я—А–µ—Б—В–Є–ґ–љ–∞ –љ–∞–≥—А–∞–і–∞ –Њ—В –С–Р–Э —Б–њ–µ—З–µ–ї–Є –≥–ї–∞–≤–љ–Є—П—В —А–µ–і–∞–Ї—В–Њ—А –љ–∞ –Э–∞—Г–Ї–∞OFFNews
–•—А–Є—Б—В–Є—П–љ–Є–љ
–Ґ–Њ–≤–∞ –µ –Ї—А–∞–ї—П—В –љ–∞ —В–Є–Ї–≤–Є—В–µ: –Ґ–Є–Ї–≤–∞—В–∞ –Љ—Г —В–µ–ґ–Є –љ–∞–і –µ–і–Є–љ –µ–і–Є–љ —В–Њ–љ
dolivo
–°–∞—Е–∞—А–∞ –Њ—З–∞–Ї–≤–∞ 75% —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–∞ –≤–∞–ї–µ–ґ–Є—В–µ –і–Њ 2100 –≥.
dolivo
–Ч–µ–Љ–љ–∞—В–∞ —П–±—К–ї–Ї–∞: —Б—В–∞—А–∞ –Ї—Г–ї—В—Г—А–∞ –Ј–∞ –љ–Њ–≤–Є—В–µ –Ї–ї–Є–Љ–∞—В–Є—З–љ–Є –≤—А–µ–Љ–µ–љ–∞