
Защо се интересуваме от мутациите? Защото те са едно от „горивата“ на еволюционния процес. За добро или за лошо, те създават разнообразие, което да се „провери от естествения подбор“.
Например: бактериите са се приспособили да консумират съвременния материал - найлон. Те „измислят“ нови ензими, които ефикасно унищожават продукт, който не е съществувал преди модерната епоха.
Средната скорост на мутациите при човека и шимпанзетата са сравними 1.0×10−8 на нуклеотид на поколение. Изследване на 78 исландски фамилии намира 60 нови мутации на поколение. Един 20-годишен баща предава средно 25 мутации на детето си, докато 40 годишен баща – към 65. Значи със всяка година от възрастта на бащата се добавят две нови мутации в детето. За сравнение, новите мутации, предавани от майка са около 15 независимо от възрастта (съгласно Kong, A. et al. Nature 488, 471–475 (2012)). Мъжките полови клетки се произвеждат непрекъснато, така минават през повече деления в сравнение с женските (яйцеклетки), които не се делят активно в индивиди в репродуктивна възраст. Намерено е, че новитe мутации са свързани с аутизъм и други заболявания. Ако възрастта на бащата води до повече нови мутации това може да доведе до заболявания в децата на възрастни бащи. Затова има предложние да се събира и замразява сперма на младини.
 Според Ламарк, тъй като жирафите разтягат вратовете си, за да достигнат листата на високите дървета, това води до укрепване и удължаване на вратовете им. Това е христоматиен пример за Ламаркизъм. Кредит: Pixabay
Според Ламарк, тъй като жирафите разтягат вратовете си, за да достигнат листата на високите дървета, това води до укрепване и удължаване на вратовете им. Това е христоматиен пример за Ламаркизъм. Кредит: Pixabay
Преди 80 години Луриа и Делбрюк установяват, че мутациите, които дават резистентност на бактериите спрямо вируси, не зависят от присъствието на вируса. Така че процесът на мутагенеза няма връзка с последствията. Това бе основен принцип в генетиката. Алтернативата – мутации насочени към определена цел се нарича Ламаркизъм, в противовес на Дарвинизма. Нови данни в последните десетилетия разкриха еволюционни механизми, които заемат място между класическия дарвинизъм и ламаркизма.
През януари 2022 г. групата на Ливнат публикува данни по мутациите на хемоглобина. Те не са нито случайни, нито насочени „по Ламарк“. Главният автор на статията – Ади Ливнат - предлага нещо по средата: генетичният и епигенетичният „фон“ влияят на мутационните тенденции и естествения им подбор. В резултат на това, мутиралият хемоглобин HbS се среща по-често в африканската популация, помагайки срещу маларията. Ади Ливнат не уточнява как работи този нов „среден“ механизъм.
Това, че мутациите не са съвсем случайни, без да бъдат „насочени“ се доказва от много данни напоследък. В изследване на растението Arabidopsis thaliana се установява модулиране на скоростта на мутации в различни функционални части от генома.
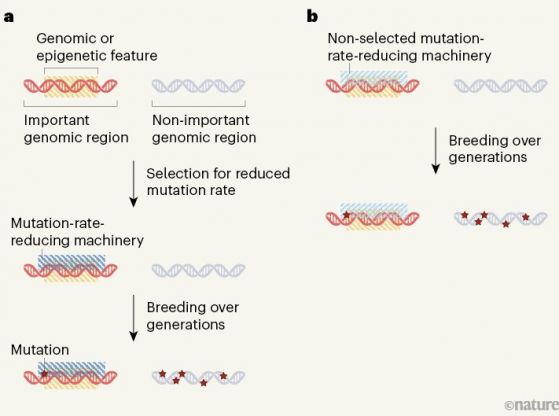 Фигура 1. Пътища за намаляване на скоростта на мутиране в по-важни геномни области : В растението Arabidopsis thaliana геномни области важни за живота и възпроизвеждането на растението, мутират по-рядко от други области. Това разграничение може да стане по два начина: Фигура 1. Пътища за намаляване на скоростта на мутиране в по-важни геномни области : В растението Arabidopsis thaliana геномни области важни за живота и възпроизвеждането на растението, мутират по-рядко от други области. Това разграничение може да стане по два начина:
а/ геномно или епигеномно (без промяна на ДНК последователността) се характеризират/бележат важните геномни области, но не и маловажните такива. Естественият подбор може да доведе до възникване на машинария, намаляваща скоростта на мутиране в тези важни геномни области и съответно в тях през поколенията ще се натрупват по-малко изменения. - b/ алтернативно, връзката между „белязането“ на генома и намаляване на скоростта на мутиране може да е вградена или страничен продукт на други биологични процеси без селекция (подбор) . Фиг. по Jianzhi Zhang Nature 602, 38-39 (2022) |
|
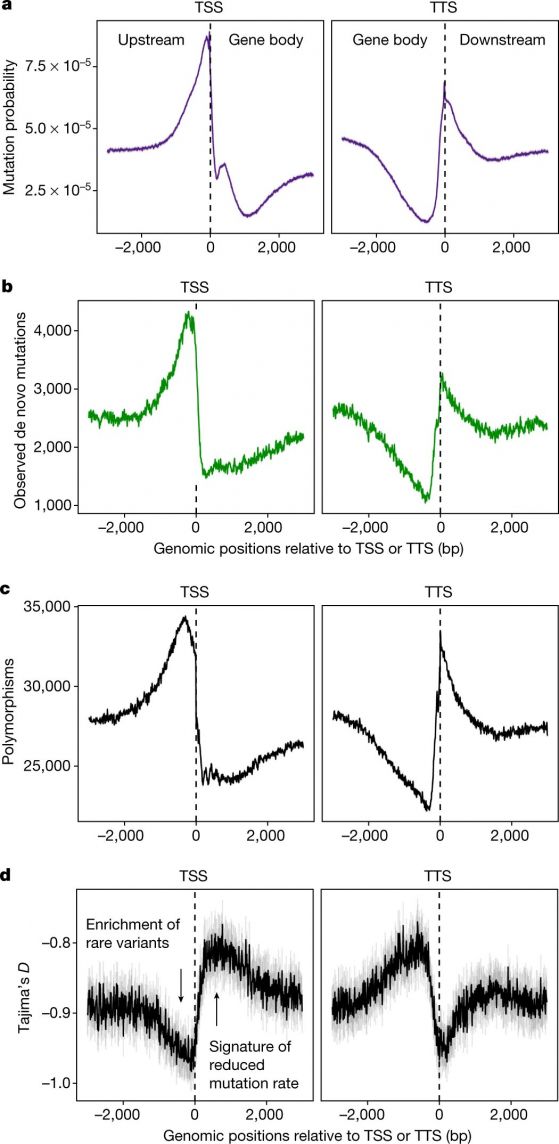
По абсцисата - геномни позиции спрямо началата на транскрипция(TSS) и краищата на транскрипция (TTS) Фигура 2: Забавена скорост на мутациите в тялото на гените. а/ Вероятност за мутации (предсказани точкови мутации SNV), моделирана по данни за епигеномните състояния и наблюдаваните мутации. b/ Наблюдавани нови мутации. c/ полиморфизми. d/ Tajima-индекс D изчислен за полиморфизмите около TSS и TTS. Kолкото е по-голяма стойността на D, толкова по-намалена е скростта на мутиране. Графиките за TSS and TTS не взимат пред вид дължината на гените или вътрегенните участъци и това, че не всички последователности пред TSS са междугенни. Тоест, не се различават междугенни области (или гени) по-дълги или по-къси от 3000 нуклеотида. Фигурата e по Monroe, J.G., et al. Mutation bias reflects natural selection in Arabidopsis thaliana. Nature 602,101–105 (2022) https://doi.org/10.1038/s41586-021-04269-6 |
Това, което авторите проверяват е, дали местата на мутациите са свързани с епигеномни характеристики: експресия на гените, състав на GC, метилиране на цитозина, хистонови модификации и достъпност на хроматина. Връзката може да е положителна или отрицателна. Например: има негативна корелация между GC състава и мутациите. GC богатите области пречат на разплитането на ДНК, което само по себе си помага на мутирането.
Знае се, че има положителна корелация между хистоновата модификация H3K4me1 (маркира енхансери и хипометилирана ДНК), ДНК-поправките и ниска мутационна скорост. За разлика, метилираните цитозини корелират с повишена мутационна скорост заради цитозиновото дезаминиране, докато достъпни хроматинови области (места на свързване на транскрипционни фактори) пречат на поправката при скъсване на ДНК (Nucleotide excision repair (NER). Така че авторите намират връзка между честотата на мутации и биохимични свойства, засягащи ДНК-поправките и уязвимостта при възникване на дефекти в ДНК. В заключение, мутациите не могат да се случват навсякъде по генома, а са ограничени в области, които не са важни за оцеляване на растението.
Примери за влияние на епигенетични фактори върху мутациите:
А/ Скорост на мутациите в човешки ракови клетки силно зависи на локалната хроматинова организация
По данни на Benjamin Schuster-Böckler и др. Nature 2012;488(7412):504-7. DOI: 10.1038/nature11273. Секвенирането на генома на ракови клетки предоставя първата пряка информация за това как се променя честотата на мутациите в човешкия геном в соматичните клетки. Тестването на различни генетични и епигенетични характеристики показва, че честотата на мутациите в раковите геноми е поразително свързана с организацията на хроматина. Действително, в мега-базов мащаб една единствена характеристика - нивото на хетерохроматиновата хистонова модификация - H3K9me3, е отговорна за повече от 40% от промените в скоростта на мутиране – това остава в сила за различни тъкани и различни видове мутации. Разпределението на генома в хетеро-хроматинови(транскрипционно неактивни) или еухроматинови (транскрипционно активни) домени доминира върху локалните промени на мутационната скорост в соматични клетки.
Б/ Chen и сътр. намират, че нуклеозомите потискат спонтанните мутации при еукариотите. Science 2012 335(6073):1235-8. DOI:10.1126/science.1217580
Не е известно как съставът и структурата на ДНК в клетката влияят върху спонтанните мутации. Теорията предполага, че в еукариотните геноми нуклеозомната ДНК претърпява по-малко C→T мутации поради потиснатото хидролитично деаминиране на цитозина в сравнение с областите на ДНК, лишени от нуклеозоми. Сравнителните геномни анализи и статистиката на мутациите показват, че разполагането на нуклеозоми почти елиминира деаминирането на цитозина, което води до ~50% намаляване на честотата на C→T мутациите в нуклеозомната ДНК. Освен това честотата на мутациите G→T и A→T също е около два пъти по-ниска в нуклеозомната ДНК. Въз основа на тези резултати стигаме до заключението, че зависимите от нуклеозомите мутационни спектри влияят върху структурата и еволюцията на еукариотните геноми и могат да имат значение за разбирането на произхода на мутациите при раковите заболявания и при индуцираните плурипотентни стволови клетки.
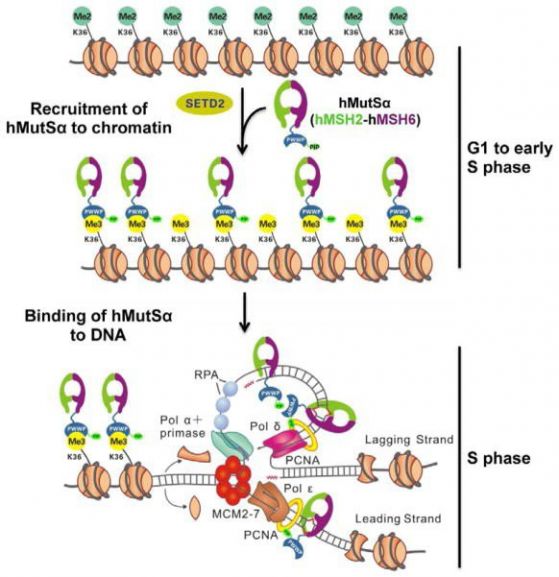
В/ Друг пример за епигенетичен механизъм за модулиране на мутациите е чрез действие върху ДНК-репарацията. Поправкатa на повреди в ДНК (mismatch repair – MMR) осигурява точна репликация на ДНК, като коригира повредите (инсерции, делеции, точкови мутации), възникнали в процесите на репликация или рекомбинация. Един епигенетичен маркер H3K36me3 (тройно метилиран лизин №36 във веригата на хистона Н3), е необходим ин виво за да „привика“ разпознаващия дефекти белтък hMutSα (hMSH2-hMSH6) върху хроматина чрез директни взаимодействия на белтъчния сегмент hMSH6 PWWP. Излишъкът на H3K36me3 в G1 и ранната S фaза осигурява обогатяването на хроматина с hMutSα преди да възникнат повреди в ДНК по време на репликация. Клетки без H3K36-триметилтрансферазата SETD2 показват микросателитна нестабилност (MSI) и повишена честота на спонтанни мутации, характерна за клетки с дефицит на MMR. Хистоновата модификация регулира MMR в човешките клетки и обяснява защо раковите клетки имат MSI и нямат детектирани мутации в известните MMR гени.
|
Фигура 3 Модел на присъединяването на hMutSα към хроматина и повредена ДНК В късна G1 и/или ранна S фаза ензимът SETD2 превръща/метилира H3K36me2 в H3K36me3. H3K36me3 закарва hMutSα върху хроматина (на фигурата - наниз от 8 нуклеозоми) чрез взаимодействие със сегмента/домена hMSH6 PWWP преди началото на ДНК репликацията. По време на репликацията нуклеозомите се деасемблират, към репликационната машинария се експонира гола ДНК, и се разрушава взаимодействието H3K36me3-PWWP. Това освобождава hMutSα от хистоновите октамери. Разпознаващият дефекти белтък (mismatch recognition protein) hMutSα (hMSH2-hMSH6) има силен афинитет към ДНК, свързва се към новосинтезираната ДНК с или без взаимодействие с PCNA. Ако възникне повреда (mismatch), hMutSα може бързо да я идентифицира и да започне репарационно действие (MMR). (По Feng Li и сътр.) Така една хистонова модификация H3K36me3 регулира ДНК поправките и с това пречи на възникването на мутации в тези епигенетично маркирани области. Cell. 2013 Apr 25; 153(3): 590–600. doi: 10.1016/j.cell.2013.03.025) |
Тези примери показват как може да се модулира скоростта и локализацията на мутациите по дължината на генома. Така че много ограничения (constrains) намаляват ролята на случайностите при мутиране. Затова, когато се разглежда структурата на съвременната еволюционна теория терминът „случайни мутации“ не фигурира. Ето как това е казано от известния корифей Ернст Мейр, който изброява следните основни принципи в еволюционната теория (вж. Mayr, E. “What evolution is”, 2001, Basic Books, New York):
- Основна еволюционна идея: непостоянство (променливост) на видовете; светът се мени и то не в кръговрат; организмите се менят с времето;
- Организмите имат общ произход (разклоняваща се еволюция);
- Постепен ход на еволюцията (без скокове);
- Многообразие на видовете. От един вид произхождат други, например при географска изолация на една популация. Разнообразието само по себе си не носи вътрешно генерирана насоченост;
- Естествен подбор.
От многообразието на индивиди и видове оцеляват само най-приспособените към променящите се условия на околната среда. Останалите отмират.
Днес тези принципи са обогатени с допълненителни механизми за еволюиране: данни по пунктуирана еволюция (със скокове), фенотипни вариации, конвергентна еволюция, трансгенерационно унаследяване на епигеномни характеристики и др. Тези „нови“ механизми показват, че околната среда може да повлияе като канализира(ограничи) изменението на гените преди на по-късен етап да заработи естественият подбор. Настояването за случайни мутации накара навремето Жак Моно да обяви, че сме били късметлии и сме продукт на случайността. Но това гледище се критикува и не се споделя от други известни еволюционисти (Саймън Конуей—Морис, Кристиян Де Дюв, Стюарт Кауфман).
Поддръжниците на интелигентния дизайн атакуват принцип №5 (естественият подбор като единствен прецеждащ механизъм) и случайността на мутациите. Разгледаните по-горе примери показват, че еволюционната теория в съвременния й вид не твърди, че случайността (генерираща разнообразие) и детерминистичният етап на естествения подбор са единствените еволюциони механизми. По-скоро се твърди, че няма насоченост при мутациите с оглед бъдещото им използуване. Съвременната теория на еволюцията се приема от над 97% от учените.
Авторът Константин К. Чипев, е физик по образование и молекулярен и клетъчен биолог по професия, PhD по биология (кандидат на биол. науки) от Университета Стони Брук в Ню Йорк, бивш сътрудник в Института по Молекулярна биология към БАН. От 1989 живее и работи в САЩ.



















Коментари
Моля, регистрирайте се от TУК!
Ако вече имате регистрация, натиснете ТУК!
Няма коментари към тази новина !
Последни коментари
Gunteer
Престижна награда от БАН спечели главният редактор на НаукаOFFNews
Християнин
Това е кралят на тиквите: Тиквата му тежи над един един тон
dolivo
Сахара очаква 75% увеличение на валежите до 2100 г.
dolivo
Земната ябълка: стара култура за новите климатични времена