

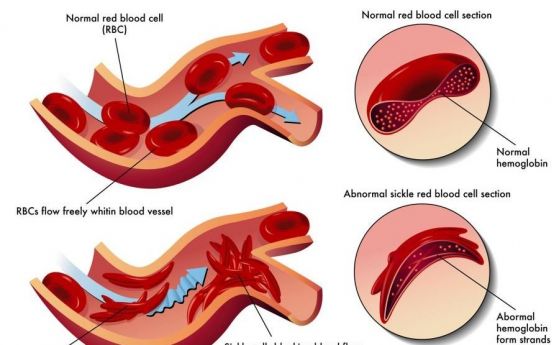
–Ď–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź—ā–į –ł —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź —Ā–į –Ĺ–į–Ļ-—Ä–į–∑–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–ł—ā–Ķ –ľ–ĺ–Ĺ–ĺ–≥–Ķ–Ĺ–Ĺ–ł –Ī–ĺ–Ľ–Ķ—Ā—ā–ł –≤ —Ā–≤–Ķ—ā–į. –Ē–Ĺ–Ķ—Ā —Ā–Ķ —Ä–į–∂–ī–į—ā 60000 –Ī–Ķ–Ī–Ķ—ā–į –≥–ĺ–ī–ł—ą–Ĺ–ĺ —Ā —ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź –ł 300 000 —Ā—ä—Ā —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ- –ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź. –ė –ī–≤–Ķ—ā–Ķ –∑–į–Ī–ĺ–Ľ—Ź–≤–į–Ĺ–ł—Ź —Ā–į –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –ľ—É—ā–į—Ü–ł—Ź –≤ –≥–Ķ–Ĺ–ł—ā–Ķ –∑–į —Ā—É–Ī–Ķ–ī–ł–Ĺ–ł—Ü–į—ā–į –Ī–Ķ—ā–į –Ĺ–į —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–į (HBB).
–ó–į–Ī–ĺ–Ľ—Ź–≤–į–Ĺ–ł—Ź—ā–į —Ā–į —Ä–Ķ—Ü–Ķ—Ā–ł–≤–Ĺ–ł - –ľ—É—ā–į—Ü–ł–ł—ā–Ķ —Ā–Ķ —É–Ĺ–į—Ā–Ľ–Ķ–ī—Ź–≤–į—ā –ł –ĺ—ā –ī–≤–į–ľ–į—ā–į —Ä–ĺ–ī–ł—ā–Ķ–Ľ–ł. –ü—Ä–ł —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź –ľ—É—ā–į—Ü–ł–ł—ā–Ķ (Glu‚Üí Val) –≤–ĺ–ī—Ź—ā –ī–ĺ —Ā–ł–Ĺ—ā–Ķ–∑–į –Ĺ–į —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ HbS ‚Äď –Ņ—Ä–ĺ–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź—ā —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –Ņ–ĺ–Ľ–ł–ľ–Ķ—Ä–ł–∑–ł—Ä–į, –ī–Ķ—Ą–ĺ—Ä–ľ–ł—Ä–į –Ķ—Ä–ł—ā—Ä–ĺ—Ü–ł—ā–ł—ā–Ķ –ł –Ņ—Ä–Ķ–ī–ł–∑–≤–ł–ļ–≤–į –į–Ĺ–Ķ–ľ–ł—Ź, —Ö–Ķ–ľ–ĺ–Ľ–ł–∑–į –ł —Ā–ļ—ä—Ā—Ź–≤–į –∂–ł–≤–ĺ—ā–į. –ú—É—ā–į—Ü–ł–ł—ā–Ķ –Ņ—Ä–ł –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź—ā–į –≤–ĺ–ī—Ź—ā –ī–ĺ –Ĺ–į–ľ–į–Ľ–Ķ–Ĺ–ĺ –ł–Ľ–ł –Ľ–ł–Ņ—Ā–≤–į—Č–ĺ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ –Ĺ–į ő≤-–≥–Ľ–ĺ–Ī–ł–Ĺ —Ā –≤—Ä–Ķ–ī–Ĺ–ł –Ņ–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł—Ź –∑–į –Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ–ł—ā–Ķ –Ĺ–į –ľ—É—ā–į—Ü–ł–ł—ā–Ķ.
–í —Ā–≤–Ķ—ā–ĺ–≤–Ķ–Ĺ –ľ–į—Č–į–Ī —Ä–į–∑–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł–Ķ—ā–ĺ –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź –ĺ–Ī—Ö–≤–į—Č–į 40% –ĺ—ā –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł–Ķ—ā–ĺ –Ĺ–į –¶–Ķ–Ĺ—ā—Ä–į–Ľ–Ĺ–į –ź—Ą—Ä–ł–ļ–į (–Ī–ĺ–Ľ–Ķ–ī—É–≤–į—Č–ĺ –ĺ—ā –ľ–į–Ľ–į—Ä–ł—Ź) –ł –ĺ–ļ–ĺ–Ľ–ĺ 10% –ĺ—ā —á–Ķ—Ä–Ĺ–ĺ–ļ–ĺ–∂–ĺ—ā–ĺ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –Ĺ–į –°–ź–©. –ü–ĺ-—Ä—Ź–ī–ļ–ĺ —Ā–Ķ —Ā—Ä–Ķ—Č–į –≤ —Ā—ā—Ä–į–Ĺ–ł—ā–Ķ –ĺ—ā –°—Ä–Ķ–ī–ł–∑–Ķ–ľ–Ĺ–ĺ–ľ–ĺ—Ä—Ā–ļ–ł—Ź –Ī–į—Ā–Ķ–Ļ–Ĺ.
–Ē–ĺ—Ā–ļ–ĺ—Ä–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ—ā–ĺ –Ī–Ķ —Ā —ā—Ä–į–Ĺ—Ā–Ņ–Ľ–į–Ĺ—ā–į—Ü–ł—Ź –Ĺ–į –ļ–ĺ—Ā—ā–Ķ–Ĺ –ľ–ĺ–∑—ä–ļ, –ļ–ĺ–Ķ—ā–ĺ –Ķ —Ä–ł—Ā–ļ–ĺ–≤–ĺ, –ł –Ĺ–į–ľ–ł—Ä–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –Ņ–ĺ–ī—Ö–ĺ–ī—Ź—Č–ł –ī–ĺ–Ĺ–ĺ—Ä–ł –Ķ —ā—Ä—É–ī–Ĺ–ĺ. –ö—Ä—ä–≤–ĺ–Ņ—Ä–Ķ–Ľ–ł–≤–į–Ĺ–Ķ —Ā—ä—Č–ĺ –Ņ–ĺ–ľ–į–≥–į, –į —Ā –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–į –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –Ĺ–į–ľ–į–Ľ—Ź—ā —Ā–≤—ä—Ä–∑–į–Ĺ–ł—ā–Ķ —Ā —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–ĺ–≤–ł—Ź –ī–Ķ—Ą–Ķ–ļ—ā –ļ—Ä–ł–∑–ł.
–ě—ā 2019 –≥. –Ķ–≤—Ä–ĺ–Ņ–Ķ–Ļ—Ā–ļ–į—ā–į –ļ–ĺ–ľ–Ņ–į–Ĺ–ł—Ź Bluebirdbio –Ņ—Ä–į–≤–ł –Ņ—Ä–Ķ–ī–ļ–Ľ–ł–Ĺ–ł—á–Ĺ–ł –ł–∑–Ņ–ł—ā–į–Ĺ–ł—Ź —Ā —Ä–Ķ–ī–ł—Ü–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł –ļ–į—ā–ĺ –Ņ—Ä–ł–Ľ–į–≥–į –≥–Ķ–Ĺ–Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź —Ā –ī–ĺ–Ī–į–≤—Ź–Ĺ–Ķ –Ĺ–į –Ľ–Ķ–Ĺ—ā–ł–≤–ł—Ä—É—Ā–ł, –Ĺ–ĺ—Ā–Ķ—Č–ł –Ĺ–ĺ—Ä–ľ–į–Ľ–Ķ–Ĺ –Ī–Ķ—ā–į-–≥–Ľ–ĺ–Ī–ł–Ĺ–ĺ–≤ –≥–Ķ–Ĺ, –ļ—ä–ľ –≤—ä–∑—Ä–į—Ā—ā–Ĺ–ł –į–≤—ā–ĺ–Ľ–ĺ–∂–Ĺ–ł —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł (CD34+) –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł (–Ņ—Ä–ĺ–ī—É–ļ—ā—ä—ā –Ķ ZYNTEGLO‚ĄĘ). –ü—Ä–ĺ–ł–∑–≤–Ķ–∂–ī–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –Ĺ–ĺ—Ä–ľ–į–Ľ–Ķ–Ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –Ĺ–į–ľ–į–Ľ—Ź–≤–į –Ņ—Ä–ĺ—Ź–≤–į—ā–į –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź –ł –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź. –ě—ā 32 –Ī–ĺ–Ľ–Ĺ–ł —Ā—ä—Ā —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź –Ľ–Ķ–ļ—É–≤–į–Ĺ–ł –Ņ—Ä–Ķ–ī–ł 3 –≥–ĺ–ī–ł–Ĺ–ł, 19 –ĺ—ā —ā—Ź—Ö –≤–Ķ—á–Ķ –Ĺ–Ķ —Ā–į –ł–ľ–į–Ľ–ł –ļ—Ä–ł–∑–ł. –í –ļ–Ľ–ł–Ĺ–ł—á–Ĺ–ł –ł–∑—Ā–Ľ–Ķ–ī–≤–į–Ĺ–ł—Ź —Ą–į–∑–į 1-2 —Ā–į –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł 50 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į —Ā—ä—Ā —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź –ł 40 —Ā –Ī–Ķ—ā–į —ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź.
–í –ī–≤–Ķ —Ā—ā–į—ā–ł–ł –Ņ—Ä–Ķ–∑ –ī–Ķ–ļ–Ķ–ľ–≤—Ä–ł 2020 –Ī–Ķ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ –ļ–į–ļ —ā–Ķ–∑–ł –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ĺ–ł –∑–į–Ī–ĺ–Ľ—Ź–≤–į–Ĺ–ł—Ź –ľ–ĺ–≥–į—ā –ī–į –Ī—ä–ī–į—ā –Ľ–Ķ–ļ—É–≤–į–Ĺ–ł —Ā —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–Ķ –Ĺ–į –≥–Ķ–Ĺ–ĺ–ľ–į –ł–Ľ–ł —á—Ä–Ķ–∑ –†—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–į –†–Ě–ö. –ó–į –ī–į –Ņ–ĺ–Ņ—Ä–į–≤—Ź—ā —Ä–į–∑–≤–į–Ľ–Ķ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ, —É—á–Ķ–Ĺ–ł—ā–Ķ –ľ–į–Ĺ–ł–Ņ—É–Ľ–ł—Ä–į—ā –ļ—Ä—ä–≤–Ĺ–ł—ā–Ķ —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł –ļ–Ľ–Ķ—ā–ļ–ł –≤–∑–Ķ—ā–ł –ĺ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā –ł –≤ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–Ĺ–ł —É—Ā–Ľ–ĺ–≤–ł—Ź —Ā–Ņ–ł—Ä–į—ā –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ—ā–ĺ –Ĺ–į BCL11A (—ā–ĺ–∑–ł –Ī–Ķ–Ľ—ā—ä–ļ –ł–∑–ļ–Ľ—é—á–≤–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–į—ā–į (–∑–į—Ä–ĺ–ī–ł—ą–Ĺ–į) —Ą–ĺ—Ä–ľ–į –Ĺ–į —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–į ‚Äď HbF (–ļ–ĺ—Ź—ā–ĺ –Ĺ–ĺ—Ä–ľ–į–Ľ–Ĺ–ĺ —Ä–į–Ī–ĺ—ā–ł –≤ —Ä–į–Ĺ–Ĺ–ł—ā–Ķ —Ā—ā–į–ī–ł–ł –ĺ—ā —Ä–į–∑–≤–ł—ā–ł–Ķ—ā–ĺ –Ĺ–į –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į). –°–Ľ–Ķ–ī —ā–ĺ–≤–į —Ā —Ö–ł–ľ–ł–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź —Ā–Ķ —É–Ĺ–ł—Č–ĺ–∂–į–≤–į—ā –Ī–ĺ–Ľ–Ĺ–ł—ā–Ķ –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł –ł —Ā–Ķ –Ņ—Ä–Ķ–Ľ–ł–≤–į—ā (–ł–Ĺ—Ą—É–∑–ł—Ä–į—ā) –ľ–į–Ĺ–ł–Ņ—É–Ľ–ł—Ä–į–Ĺ–ł—ā–Ķ —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł –ļ–Ľ–Ķ—ā–ļ–ł. –Ę–į–ļ–į —Ā –ĺ—ā—Ā—ā—Ä–į–Ĺ—Ź–≤–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –ł–∑–ļ–Ľ—é—á–≤–į—ā–Ķ–Ľ—Ź BCL11A, —Ā–Ķ –∑–į–ľ–Ķ–Ĺ—Ź ‚Äě–Ľ–ĺ—ą–ł—Ź‚Äú –≤—ä–∑—Ä–į—Ā—ā–ĺ–≤ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –ł —Ā–Ķ —Ä–Ķ-–į–ļ—ā–ł–≤–ł—Ä–į –≥–Ķ–Ĺ–į –∑–į HbF. –ü—Ä–ł —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź —á–į—Ā—ā –ĺ—ā –≤—ä–∑—Ä–į—Ā—ā–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ —Ā–Ķ –∑–į–ľ–Ķ–Ĺ—Ź —Ā –Ĺ–ĺ—Ä–ľ–į–Ľ–Ķ–Ĺ –Ī–Ķ–Ľ—ā—ä–ļ, –ł —Ā —ā–ĺ–≤–į —Ā–Ķ –Ī–Ľ–ĺ–ļ–ł—Ä–į —Ą–ĺ—Ä–ľ–ł—Ä–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –Ľ–Ķ–Ņ–Ľ–ł–≤–ł—ā–Ķ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–ĺ–≤–ł –Ņ–ĺ–Ľ–ł–ľ–Ķ—Ä–ł, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ł –∑–į —ā–į–∑–ł –į–Ĺ–Ķ–ľ–ł—Ź. –ü—Ä–ł –Ī–Ķ—ā–į-—ā–Ľ–į—Ā–Ķ–ľ–ł—Ź—ā–į —Ä–Ķ–į–ļ—ā–ł–≤–ł—Ä–į–Ĺ–Ķ—ā–ĺ –Ĺ–į —Ā–ł–Ĺ—ā–Ķ–∑–į—ā–į –Ĺ–į HbF –Ņ—Ä–Ķ–ĺ–ī–ĺ–Ľ—Ź–≤–į –Ĺ–Ķ–ī–ĺ—Ā—ā–ł–≥–į –Ĺ–į —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ.
–ü—Ä–ł –Ņ—ä—Ä–≤–ł—Ź –Ņ–ĺ–ī—Ö–ĺ–ī –Ķ–Ĺ–∑–ł–ľ—ä—ā CRISPR-Cas9 –≤ —Ä–ł–Ī–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ–ĺ–≤ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā —Ā—ä—Ā —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–į –≤–ĺ–ī–Ķ—Č–į –†–ĚK (sgRNA) —Ā–Ķ —ā—Ä–į–Ĺ—Ā—Ą–Ķ–ļ—ā–ł—Ä–į (–Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ņ–ĺ—Ä–ł—Ä–į, –Ĺ—É–ļ–Ľ–Ķ–ĺ—Ą–Ķ–ļ—ā–ł—Ä–į) –≤ –ļ—Ä—ä–≤–Ĺ–ł—ā–Ķ —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł –ļ–Ľ–Ķ—ā–ļ–ł, –ļ—ä–ī–Ķ—ā–ĺ –≤ –ļ–Ľ–Ķ—ā—ä—á–Ĺ–ĺ—ā–ĺ —Ź–ī—Ä–ĺ —Ä–į–∑—Ä—É—ą–į–≤–į —É—á–į—Ā—ā—ä–ļ –ĺ—ā –≥–Ķ–Ĺ–į –Ĺ–į —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ł—Ź —Ą–į–ļ—ā–ĺ—Ä BCL11A, –ł —Ā —ā–ĺ–≤–į –≥–ĺ –Ņ—Ä–į–≤–ł –Ĺ–Ķ–į–ļ—ā–ł–≤–Ķ–Ĺ (1). –ü—Ä–ł –≤—ā–ĺ—Ä–ł—Ź –Ņ–ĺ–ī—Ö–ĺ–ī —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑—É–≤–į –Ī–Ķ–∑–≤—Ä–Ķ–ī–Ķ–Ĺ –≤–ł—Ä—É—Ā (–Ľ–Ķ–Ĺ—ā–ł–≤–ł—Ä—É—Ā), –ļ–ĺ–Ļ—ā–ĺ –≤–ļ–į—Ä–≤–į –≤ –ļ—Ä—ä–≤–Ĺ–ł—ā–Ķ —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł –ļ–Ľ–Ķ—ā–ļ–ł –Ķ–ī–Ĺ–ĺ –Ņ–į—Ä—á–Ķ –Ē–Ě–ö, –ļ–ĺ–Ķ—ā–ĺ –ļ–ĺ–ī–ł—Ä–į –ł–Ĺ—Ö–ł–Ī–ł—Ä–į—Č–į –†–Ě–ö-–≤–Ķ—Ä–ł–∂–ļ–į (–ł–Ĺ—Ö–ł–Ī–ł—Ä–į—Č–į –†–Ě–ö - shRNA, small hairpin RNA), –ļ–ĺ—Ź—ā–ĺ —É–Ĺ–ł—Č–ĺ–∂–į–≤–į —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—ā–į –Ĺ–į BCL11–ź ‚Äď –†–Ě–ö –≤–Ķ—Ä–ł–≥–į—ā–į –Ĺ–į BCL11–ź. –Ę–ĺ–∑–ł –ľ–Ķ—ā–ĺ–ī —Ā–Ķ –Ĺ–į—Ä–ł—á–į –†–Ě–ö-–ł–Ĺ—ā–Ķ—Ä—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ź - RNAi. –ė –≤ –ī–≤–į—ā–į —Ā–Ľ—É—á–į—Ź —Ā–Ķ —Ā—ā–ł–≥–į –ī–ĺ –Ĺ–Ķ—É—ā—Ä–į–Ľ–ł–∑–ł—Ä–į–Ĺ–Ķ/–ĺ—ā—Ā—ā—Ä–į–Ĺ—Ź–≤–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ—ā–ĺ –Ĺ–į BCL11–ź. —ā–ĺ–Ļ –≤–Ķ—á–Ķ –Ĺ–Ķ –ľ–ĺ–∂–Ķ –ī–į –Ņ—Ä–Ķ—á–ł –Ĺ–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ HbF.
–ü—Ä–ł –ī–≤–į—ā–į –Ņ–ĺ–ī—Ö–ĺ–ī–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł—ā–Ķ –Ņ–ĺ–ļ–į–∑–≤–į—ā –ī–ĺ—Ā—ā–į—ā—ä—á–Ĺ–ĺ –≤–ł—Ā–ĺ–ļ–ł –Ĺ–ł–≤–į –Ĺ–į HbF –ł –≤–Ķ—á–Ķ –Ĺ—Ź–ľ–į—ā —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ł—ā–Ķ –Ĺ–į –∑–į–Ī–ĺ–Ľ—Ź–≤–į–Ĺ–ł—Ź—ā–į. –í –Ď–ĺ—Ā—ā—ä–Ĺ—Ā–ļ–į—ā–į –ļ–Ľ–ł–Ĺ–ł–ļ–į –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź—ā–į —Ā–į –Ņ–ĺ–ī–Ľ–ĺ–∂–Ķ–Ĺ–ł —ą–Ķ—Ā—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –∑–į —ą–Ķ—Ā—ā –ľ–Ķ—Ā–Ķ—Ü–į. –°–į–ľ–ĺ –≤ –Ķ–ī–ł–Ĺ —Ā–Ľ—É—á–į–Ļ —Ā–Ķ –Ķ –Ĺ–į–Ľ–ĺ–∂–ł–Ľ–ĺ –ļ—Ä—ä–≤–ĺ–Ņ—Ä–Ķ–Ľ–ł–≤–į–Ĺ–Ķ. –ē–ī–Ĺ–ĺ –ľ–ĺ–ľ—á–Ķ, –Ņ–ĺ–ī–Ľ–ĺ–∂–Ķ–Ĺ–ĺ –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź—ā–į, –ľ–ĺ–∂–Ķ —Ā–Ķ–≥–į –ī–į –Ņ–Ľ—É–≤–į –Ī–Ķ–∑ –Ī–ĺ–Ľ–ļ–į, –į –ī—Ä—É–≥ –ľ–Ľ–į–ī–Ķ–∂ , –ļ–ĺ–Ļ—ā–ĺ –Ĺ–Ķ –Ķ –ľ–ĺ–∂–Ķ–Ľ –Ī–Ķ–∑ –ļ—Ä—ä–≤–ĺ–Ņ—Ä–Ķ–Ľ–ł–≤–į–Ĺ–ł—Ź –ĺ—ā 2.5 –≥–ĺ–ī–ł–Ĺ–ł, –Ĺ—Ź–ľ–į –≤–Ķ—á–Ķ —ā–ĺ–∑–ł –∑–ī—Ä–į–≤–ĺ—Ā–Ľ–ĺ–≤–Ķ–Ĺ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ –ł —Ā–Ķ —á—É–≤—Ā—ā–≤–į —Ā—ä–≤—Ā–Ķ–ľ –∑–ī—Ä–į–≤.
–ü—ä—Ä–≤–ł—Ź—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā, –í–ł–ļ—ā–ĺ—Ä–ł—Ź –ď—Ä–Ķ–Ļ, –ļ–ĺ—Ź—ā–ĺ –Ķ –Ņ–ĺ–Ľ—É—á–ł–Ľ–į CRISPR —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ—Ä–Ķ–ī–ł 17 –ľ–Ķ—Ā–Ķ—Ü–į —Ā–Ķ —á—É–≤—Ā—ā–≤–į –ĺ—ā–Ľ–ł—á–Ĺ–ĺ. –°–ł–ľ–Ņ—ā–ĺ–ľ–ł—ā–Ķ —Ā–į –Ĺ–į–ľ–į–Ľ–Ķ–Ĺ–ł, –ļ–į–∑–≤–į —Ö–Ķ–ľ–į—ā–ĺ–Ľ–ĺ–≥—ä—ā –§—Ä–į–Ĺ–≥—É–Ľ: ‚Äě–í—Ā–Ķ–ļ–ł –Ņ—ä—ā –ļ–į—ā–ĺ –Ļ —Ā–Ķ –ĺ–Ī–į–ī—Ź –ł–Ľ–ł —Ź –≤–ł–ī—Ź –≤ –ļ–Ľ–ł–Ĺ–ł–ļ–į—ā–į, —ā—Ź —Ā–Ķ —á—É–≤—Ā—ā–≤–į —á—É–ī–Ķ—Ā–Ĺ–ĺ‚Äú. –ö–ĺ–ľ–Ņ–į–Ĺ–ł–ł—ā–Ķ CRISPR Therapeutics –ł Vertex –ĺ–Ņ–ł—Ā–≤–į—ā —Ä–Ķ–∑—É–Ľ—ā–į—ā–ł—ā–Ķ —Ā –ď—Ä–Ķ–Ļ –ł –Ķ–ī–ł–Ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā —Ā –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź, —ā—Ä–Ķ—ā–ł—Ä–į–Ĺ –Ņ—Ä–Ķ–ī–ł 22 –ľ–Ķ—Ā–Ķ—Ü–į (1). ‚Äě–†–Ķ–∑—É–Ľ—ā–į—ā–ł—ā–Ķ —Ā–į –ľ–Ĺ–ĺ–≥–ĺ –≤–Ņ–Ķ—á–į—ā–Ľ—Ź–≤–į—Č–ł‚Äú, –ļ–į–∑–≤–į –°—ā—é–į—Ä—ā O—Ä–ļ–ł–Ĺ –ĺ—ā –Ď–ĺ—Ā—ā–ĺ–Ĺ—Ā–ļ–į—ā–į –ī–Ķ—ā—Ā–ļ–į –ļ–Ľ–ł–Ĺ–ł–ļ–į, –≤ —á–ł—Ź—ā–ĺ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł—Ź –Ķ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ –ļ–į–ļ –ī–į —Ā–Ķ –Ĺ–Ķ—É—ā—Ä–į–Ľ–ł–∑–ł—Ä–į BCL11A, —á—Ä–Ķ–∑ –ł–∑—Ä—Ź–∑–≤–į–Ĺ–Ķ –Ĺ–į –Ē–Ě–ö –≤ —Ä–Ķ–≥—É–Ľ–į—ā–ĺ—Ä–Ĺ–į –ĺ–Ī–Ľ–į—Ā—ā(–Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä) –Ĺ–į –≥–Ķ–Ĺ–į BCL11–ź. –ě–ļ–ĺ–Ľ–ĺ 80% –ĺ—ā –Ē–Ě–ö –≤ —ā–ĺ–∑–ł –Ľ–ĺ–ļ—É—Ā —Ā–į –Ī–ł–Ľ–ł –ľ–ĺ–ī–ł—Ą–ł—Ü–ł—Ä–į–Ĺ–ł (—Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–ł) –Ī–Ķ–∑ –ł–Ĺ–ī–ł–ļ–į—Ü–ł—Ź –∑–į —Ä–Ķ–ī–į–ļ—Ü–ł–ł –Ĺ–į –ī—Ä—É–≥–ł –ľ–Ķ—Ā—ā–į. –ē–ī–Ĺ–į –≥o–ī–ł–Ĺ–į —Ā–Ľ–Ķ–ī –ļ–į—ā–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł—ā–Ķ —Ā–į –Ņ–ĺ–Ľ—É—á–ł–Ľ–ł –į–≤—ā–ĺ–Ľ–ĺ–∂–Ĺ–ł CD34+ –ļ–Ľ–Ķ—ā–ļ–ł —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–ł —Ā CRISPR-–°as9 –Ĺ–ł–≤–ĺ—ā–ĺ –Ĺ–į —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–ł—ā–Ķ –į–Ľ–Ķ–Ľ–ł (–ī–≤–ĺ–Ļ–ļ–ł BCL11A –≥–Ķ–Ĺ–ł) –≤ –ļ–ĺ—Ā—ā–Ĺ–ł—Ź –ľ–ĺ–∑—ä–ļ –ł –≤ –ļ—Ä—ä–≤—ā–į –Ņ—Ä–ĺ–ī—ä–Ľ–∂–į–≤–į –ī–į –Ķ –≤–ł—Ā–ĺ–ļ–ĺ.–ü–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ–Ĺ–ł —Ä–Ķ–∑—É–Ľ—ā–į—ā–ł –ł–ľ–į —Ā –ĺ—Č–Ķ –ī–Ķ—Ā–Ķ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į —Ā —ā–Ķ–∑–ł –∑–į–Ī–ĺ–Ľ—Ź–≤–į–Ĺ–ł—Ź.
–ē—ā–ĺ –ī–Ķ—ā–į–Ļ–Ľ–ł –Ņ–ĺ –ł–∑–Ņ–ĺ–Ľ–∑—É–≤–į–Ĺ–ł—ā–Ķ –ľ–Ķ—ā–ĺ–ī–ł–ļ–ł:
I. –ď–Ķ–Ĺ–Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź –ł –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—ā–į —á—Ä–Ķ–∑ CRISPR-—Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–Ķ –Ĺ–į BCL11A
BCL11A –Ķ —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ķ–Ĺ —Ą–į–ļ—ā–ĺ—Ä, –ļ–ĺ–Ļ—ā–ĺ –Ņ–ĺ—ā–ł—Ā–ļ–į –Ķ–ļ—Ā–Ņ—Ä–Ķ—Ā–ł—Ź—ā–į –Ĺ–į ő≥-–≥–Ľ–ĺ–Ī—É–Ľ–ł–Ĺ–į –≤ –∑–į—Ä–ĺ–ī–ł—ą–Ĺ–ł—Ź (—Ą–Ķ—ā–į–Ľ–Ķ–Ĺ) —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –≤ –Ķ—Ä–ł—ā—Ä–ĺ–ł–ī–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł. –ě—Ā–≤–Ķ–Ĺ –≤ —ā—Ź—Ö, BCL11–ź —Ā–Ķ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–∂–ī–į –ł –≤ –ľ–ĺ–∑—ä—á–Ĺ–į—ā–į —ā—ä–ļ–į–Ĺ. –ė–∑–Ī–ł—Ä–į —Ā–Ķ –Ņ—Ä–ł—Ü–Ķ–Ľ–≤–į–Ĺ–Ķ—ā–ĺ –Ĺ–į –Ĺ—É–ļ–Ľ–Ķ–į–∑–į—ā–į CRISPR-Cas9 —á—Ä–Ķ–∑ –≤–ĺ–ī–Ķ—Č–į –†–Ě–ö (sgRNA) –ī–į –Ķ –ļ—ä–ľ –Ķ—Ä–ł—ā—Ä–ĺ–ł–ī–Ĺ–ĺ-—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–į—ā–į –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä–Ĺ–į –ĺ–Ī–Ľ–į—Ā—ā –Ĺ–į BCL11. –Ě—É–ļ–Ľ–Ķ–į–∑–į—ā–į –≤–ĺ–ī–ł –ī–ĺ –Ĺ–į–ľ–į–Ľ—Ź–≤–į–Ĺ–Ķ –Ĺ–į –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į BCL11–ź –ł —É–≤–Ķ–Ľ–ł—á–į–≤–į–Ĺ–Ķ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ. –†–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–Ķ—ā–ĺ —Ā CRISPR- —Ā—ā–į–≤–į —Ā–į–ľ–ĺ –≤ —á–Ķ—Ä–≤–Ķ–Ĺ–ł—ā–Ķ –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł, –ł –Ĺ—Ź–ľ–į –Ĺ–į—Ä—É—ą–į–Ĺ–Ķ –Ĺ–į –≥–Ķ–Ĺ–ĺ–ľ–į –≤ –ī—Ä—É–≥–ł –ľ–Ķ—Ā—ā–į –ĺ—ā –ĺ—Ä–≥–į–Ĺ–ł–∑—ä–ľ–į.
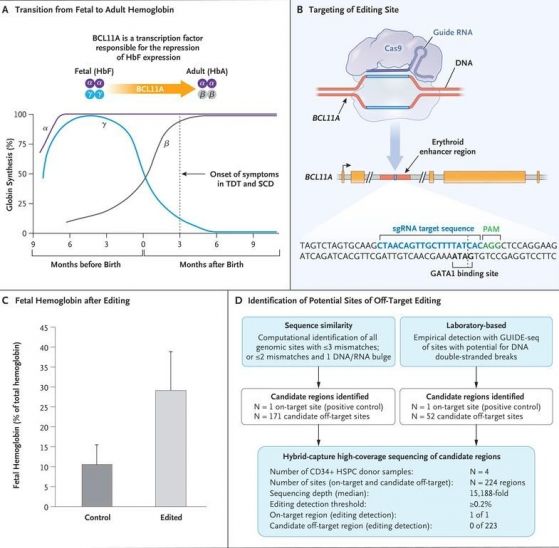
–§–ł–≥. 1 –Ņ–ĺ Frangoul –ł —Ā—ä—ā—Ä. –≤ N Engl J Med 2021;384:252-60. DOI: 10.1056/NEJMoa2031054
A –Ņ–ĺ–ļ–į–∑–≤–į –Ņ—Ä–Ķ—Ö–ĺ–ī–į –ĺ—ā —Ą–Ķ—ā–į–Ľ–Ķ–Ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ (HbF) –ļ—ä–ľ –≤—ä–∑—Ä–į—Ā—ā–ĺ–≤–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ (HbA) —Ā–ļ–ĺ—Ä–ĺ —Ā–Ľ–Ķ–ī —Ä–į–∂–ī–į–Ĺ–Ķ—ā–ĺ –ł —Ä–ĺ–Ľ—Ź—ā–į –Ĺ–į —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ł—Ź —Ą–į–ļ—ā–ĺ—Ä BCL11A –≤ —É–Ņ—Ä–į–∂–Ĺ—Ź–≤–į–Ĺ–Ķ –Ĺ–į —Ä–Ķ–Ņ—Ä–Ķ—Ā–ł—Ź –Ĺ–į ő≥-–≥–Ľ–ĺ–Ī–ł–Ĺ–į, –Ķ–ī–ł–Ĺ –ĺ—ā –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ł—ā–Ķ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ. –ü—Ä–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł, –ļ–ĺ–ł—ā–ĺ –Ĺ–Ķ –ľ–ĺ–≥–į—ā –ī–į –Ņ—Ä–ĺ–ł–∑–≤–Ķ–∂–ī–į—ā –ī–ĺ—Ā—ā–į—ā—ä—á–Ĺ–ĺ —Ą—É–Ĺ—Ü–ł–ĺ–Ĺ–ł—Ä–į—Č ő≤-–≥–Ľ–ĺ–Ī–ł–Ĺ, —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ł—ā–Ķ —Ā–Ķ –Ņ–ĺ—Ź–≤—Ź–≤–į—ā —Ā–Ľ–Ķ–ī —Ā–Ņ–į–ī–į–Ĺ–Ķ –Ĺ–į –Ĺ–ł–≤–ĺ—ā–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –ĺ–ļ–ĺ–Ľ–ĺ —ā—Ä–ł –ľ–Ķ—Ā–Ķ—Ü–į —Ā–Ľ–Ķ–ī —Ä–į–∂–ī–į–Ĺ–Ķ—ā–ĺ. SCD ‚Äď —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź, TDT- —ā—Ä–į–Ĺ—Ā—Ą—É–∑–ł–ĺ–Ĺ–Ĺ–ĺ-–∑–į–≤–ł—Ā–ł–ľ–į ő≤-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź.
B¬†–Ņ–ĺ–ļ–į–∑–≤–į –ļ–į–ļ —Ā–Ķ ‚Äě–Ņ—Ä–ł—Ü–Ķ–Ľ–≤–į‚Äú –≤–ĺ–ī–Ķ—Č–į—ā–į –†–Ě–ö (sgRNA) –≤ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā —Ā CRISPR-Cas9 –ļ—ä–ľ –Ķ—Ä–ł—ā—Ä–ĺ–ł–ī–Ĺ–ĺ-—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–į—ā–į –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä–Ĺ–į –ĺ–Ī–Ľ–į—Ā—ā –≤ –≥–Ķ–Ĺ–į –Ĺ–į¬†BCL11A. –ü–Ķ—ā—ā–Ķ –Ķ–ļ–∑–ĺ–Ĺ–į –Ĺ–į BCL11A —Ā–į –ĺ–∑–Ĺ–į—á–Ķ–Ĺ–ł —Ā—ä—Ā –∑–Ľ–į—ā–Ĺ–ł –ļ—É—ā–ł–Ļ–ļ–ł. GATA1 –Ķ –ľ—Ź—Ā—ā–ĺ—ā–ĺ –≤ –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä–Ĺ–į—ā–į –ĺ–Ī–Ľ–į—Ā—ā –Ĺ–į BCL11, –ļ—ä–ī–Ķ—ā–ĺ —Ā–Ķ —Ā–≤—ä—Ä–∑–≤–į —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ł—Ź —Ą–į–ļ—ā–ĺ—Ä G–ź–Ę–ź1. CRISPR-Cas9 —Ā –Ņ–ĺ–ľ–ĺ—Č—ā–į –Ĺ–į –≤–ĺ–ī–Ķ—Č–į—ā–į –†–Ě–ö —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä–į –Ĺ–į –≥–Ķ–Ĺ–į –ļ–į—ā–ĺ –≥–ĺ –Ĺ–Ķ—É—ā—Ä–į–Ľ–ł–∑–ł—Ä–į = —Ā–ļ—ä—Ā–≤–į –≥–ĺ, –ł —Ā–Ľ–Ķ–ī —Ä–Ķ–Ņ–į—Ä–į—Ü–ł—Ź—ā–į –Ĺ–į –Ē–Ě–ö ‚Äě–∑–į–ļ—ä—Ä–Ņ–Ķ–Ĺ–ł—Ź—ā‚Äú –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä –≤–Ķ—á–Ķ –Ĺ–Ķ —Ä–į–Ī–ĺ—ā–ł –≤ –Ņ–ĺ–Ľ–∑–į –Ĺ–į BCL11A, –∑–į—Č–ĺ—ā–ĺ –Ĺ–Ķ –Ĺ–ĺ—Ā–ł —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–ĺ—ā–ĺ –ľ—Ź—Ā—ā–ĺ –∑–į —Ā–≤—ä—Ä–≤–į–Ĺ–Ķ –Ĺ–į —ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ł—Ź —Ą–į–ļ—ā–ĺ—Ä GATA1.
C –Ņ–ĺ–ļ–į–∑–≤–į –Ņ—Ä–Ķ–ļ–Ľ–ł–Ĺ–ł—á–Ĺ–ł—ā–Ķ –ī–į–Ĺ–Ĺ–ł –∑–į –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā–į –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ —Ā–Ņ—Ä—Ź–ľ–ĺ –ĺ–Ī—Č–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ —Ā–Ľ–Ķ–ī —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–Ķ—ā–ĺ (–Ķ–Ĺ–∑–ł–ľ—ä—ā CRISPR-Cas9 –∑–į–Ķ–ī–Ĺ–ĺ —Ā –≤–ĺ–ī–Ķ—Č–į—ā–į –†–Ě–ö —Ā–ļ—ä—Ā–≤–į –≥–Ķ–Ĺ–į –Ĺ–į BCL11–ź –≤ –Ķ–Ĺ—Ö–į–Ĺ—Ā–Ķ—Ä–Ĺ–į—ā–į –≥–Ķ–Ĺ–ĺ–ľ–Ĺ–į –ĺ–Ī–Ľ–į—Ā—ā, –ļ–ĺ—Ź—ā–ĺ —Ā–Ľ–Ķ–ī —Ä–Ķ–Ņ–į—Ä–ł—Ä–į–Ĺ–Ķ –Ĺ–į –Ē–Ě–ö –Ĺ—Ź–ľ–į –ī–į –ľ–ĺ–∂–Ķ –ī–į –Ī—ä–ī–Ķ –Ņ–ĺ–Ľ–Ķ–∑–Ĺ–į –∑–į –Ķ–ļ—Ā–Ņ—Ä–Ķ—Ā–ł—Ź—ā–į –Ĺ–į –≥–Ķ–Ĺ–į, –ł –≤ —Ä–Ķ–∑—É–Ľ—ā–į—ā —Č–Ķ —Ā–Ķ —É–≤–Ķ–Ľ–ł—á–ł –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ—ā–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ķ–Ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ) –ł –ī–ł—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ź—Ü–ł—Ź—ā–į –Ĺ–į –Ķ—Ä–ł—ā—Ä–ĺ–ł–ī–Ĺ–ł—ā–Ķ –ļ–Ľ–Ķ—ā–ļ–ł. –Ē–į–Ĺ–Ĺ–ł—ā–Ķ —Ā–į –ĺ—ā –ī–Ķ—Ā–Ķ—ā –∑–ī—Ä–į–≤–ł –ī–ĺ–Ī—Ä–ĺ–≤–ĺ–Ľ—Ü–ł.
D –Ņ–ĺ–ļ–į–∑–≤–į —Ä–Ķ–∑—É–Ľ—ā–į—ā–ł—ā–Ķ –ĺ—ā –ł–∑—Ā–Ľ–Ķ–ī–≤–į–Ĺ–ł—Ź –Ņ–ĺ —Ü–Ķ–Ľ–ł—Ź –≥–Ķ–Ĺ–ĺ–ľ –∑–į –≤—ä–∑–ľ–ĺ–∂–Ĺ–ł –ī–≤—É–≤–Ķ—Ä–ł–∂–Ĺ–ł —Ā–ļ—ä—Ā–≤–į–Ĺ–ł—Ź –≤ –Ņ–ĺ—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ–Ĺ–ĺ—Ā—ā–ł, —Ä–į–∑–Ľ–ł—á–į–≤–į—Č–ł —Ā–Ķ –ĺ—ā —ā–ĺ—á–Ĺ–į—ā–į —Ā–Ķ–ļ–≤–Ķ–Ĺ—Ü–ł—Ź –Ĺ–į –≤–ĺ–ī–Ķ—Č–į—ā–į –†–Ě–ö. –ě—ā 223 –≤—ä–∑–ľ–ĺ–∂–Ĺ–ł –ľ–Ķ—Ā—ā–į –Ņ–ĺ –≥–Ķ–Ĺ–ĺ–ľ–į, —Ä–į–∑–Ľ–ł—á–į–≤–į—Č–ł —Ā–Ķ —Ā –Ķ–ī–ł–Ĺ, –ī–≤–į –ł–Ľ–ł —ā—Ä–ł –Ĺ—É–ļ–Ľ–Ķ–ĺ—ā–ł–ī–į, –Ĺ–Ķ —Ā–Ķ –ł–ī–Ķ–Ĺ—ā–ł—Ą–ł—Ü–ł—Ä–į –Ĺ–ł—ā–ĺ –Ķ–ī–Ĺ–ĺ —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–ĺ —Ā–ļ—ä—Ā–≤–į–Ĺ–Ķ –Ĺ–į –Ē–Ě–ö, –∑–į —Ä–į–∑–Ľ–ł–ļ–į –ĺ—ā —Ä–Ķ–ī–į–ļ—Ü–ł–ĺ–Ĺ–Ĺ–ł—ā–Ķ —Ā–ļ—ä—Ā–≤–į–Ĺ–ł—Ź, –ļ–ĺ–≥–į—ā–ĺ —Ā–Ķ —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į/—Ā–ļ—ä—Ā–≤–į —ā–ĺ—á–Ĺ–į—ā–į –Ē–Ě–ö –Ņ–ĺ—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ–Ĺ–ĺ—Ā—ā.
II. –ď–Ķ–Ĺ–Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź –ł –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź —á—Ä–Ķ–∑ –Ņ–ĺ—Ā—ā-—ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –∑–į–≥–Ľ—É—ą–į–≤–į–Ĺ–Ķ –Ĺ–į BCL11A.¬†
–ė —ā—É–ļ —Ā–Ķ –ł–∑–Ņ–ĺ–Ľ–∑—É–≤–į —Ą–į–ļ—ā–į —á–Ķ BCL11A –Ķ —Ä–Ķ–Ņ—Ä–Ķ—Ā–ĺ—Ä –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź ő≥-–≥–Ľ–ĺ–Ī–ł–Ĺ –≤—ä–≤ –≤—ä–∑—Ä–į—Ā—ā–Ĺ–ł –Ķ—Ä–ł—ā—Ä–ĺ—Ü–ł—ā–ł. –Ę–Ķ—Ä–į–Ņ–ł—Ź—ā–į –≤–ļ–Ľ—é—á–≤–į —ā—Ä–į–Ĺ—Ā—Ą—É–∑–ł—Ź –Ĺ–į –į–≤—ā–ĺ–Ľ–ĺ–∂–Ĺ–ł —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł –ļ–Ľ–Ķ—ā–ļ–ł (CD34+), —ā—Ä–į–Ĺ—Ā–ī—É—Ü–ł—Ä–į–Ĺ–ł —Ā –Ľ–Ķ–Ĺ—ā–ł–≤–ł—Ä—É—Ā–Ķ–Ĺ –≤–Ķ–ļ—ā–ĺ—Ä BCH-B694, –ļ–ĺ–Ļ—ā–ĺ –ļ–ĺ–ī–ł—Ä–į –ļ—ä—Ā–į –†–Ě–ö (–ľ–ł–ļ—Ä–ĺ–†–Ě–ö) —Ā—ä—Ā —Ā—ā—Ä—É–ļ—ā—É—Ä–į –Ĺ–į —Ą–ł–Ī–į (shRNA), –ļ–ĺ—Ź—ā–ĺ –Ķ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–į—Ä–Ĺ–į —Ā –ľ–†–Ě–ö –Ĺ–į ¬†BCL11A –≥–Ķ–Ĺ–į. –Ě–ĺ–ļ–į—É—ā–ł—Ä–į–Ĺ–Ķ –Ĺ–į BCL11A –≤ —á–Ķ—Ä–≤–Ķ–Ĺ–ł—ā–Ķ –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł –ł –ł–ľ –ī–į–≤–į –≤—ä–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā –ī–į —Ā–ł–Ĺ—ā–Ķ–∑–ł—Ä–į—ā —Ą–Ķ—ā–į–Ľ–Ķ–Ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ (HbF). –Ę–į–ļ–į —Ā–Ķ –ļ–ĺ–ľ–Ņ–Ķ–Ĺ—Ā–ł—Ä–į –Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ł—Ź –Ķ—Ą–Ķ–ļ—ā –Ĺ–į –ľ—É—ā–į—Ü–ł–ł—ā–Ķ –≤—ä–≤ –≤—ä–∑—Ä–į—Ā—ā–Ĺ–ł—Ź —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ķ–Ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ (HbS) –ł–Ľ–ł –Ĺ–Ķ–ī–ĺ—Ā—ā–ł–≥–į –Ĺ–į –Ĺ–ĺ—Ä–ľ–į–Ľ–Ķ–Ĺ –≤—ä–∑—Ä–į—Ā—ā–ĺ–≤ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –Ņ—Ä–ł –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź—ā–į.
–ö—ä–ľ –ĺ–ļ—ā–ĺ–ľ–≤—Ä–ł 2020 —ą–Ķ—Ā—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł —Ā—ä—Ā —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź —Ā–į —Ā–Ľ–Ķ–ī–Ķ–Ĺ–ł –≤ –Ņ—Ä–ĺ–ī—ä–Ľ–∂–Ķ–Ĺ–ł–Ķ –Ĺ–į —ą–Ķ—Ā—ā –ľ–Ķ—Ā–Ķ—Ü–į —Ā–Ľ–Ķ–ī –≥–Ķ–Ĺ–Ĺ–į—ā–į —ā–Ķ—Ä–į–Ņ–ł—Ź. –ü—Ä–ĺ—Ü–Ķ–Ĺ—ā—ä—ā HbF/(F+S) –Ķ –ľ–Ķ–∂–ī—É 20.4 –ł 41.3%, –ļ–į—ā–ĺ HbF –Ķ —ą–ł—Ä–ĺ–ļ–ĺ —Ä–į–∑–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ –ł–∑ —á–Ķ—Ä–≤–Ķ–Ĺ–ł—ā–Ķ –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł. –°–ł–ľ–Ņ—ā–ĺ–ľ–ł—ā–Ķ –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź —Ā–į –Ĺ–į–ľ–į–Ľ–Ķ–Ĺ–ł –ł–Ľ–ł –ĺ—ā—Ā—ä—Ā—ā–≤–į—ā.

–§–ł–≥.2
–ė–∑—Ā–Ľ–Ķ–ī–≤–į–Ĺ–Ķ—ā–ĺ (2) –Ņ–ĺ–ļ–į–∑–≤–į, —á–Ķ –Ņ–ĺ—Ā—ā-—ā—Ä–į–Ĺ—Ā–ļ—Ä–ł–Ņ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ—ā–ĺ –∑–į–≥–Ľ—É—ą–į–≤–į–Ĺ–Ķ –Ĺ–į BCL11A –Ķ –Ņ–ĺ–ī—Ö–ĺ–ī—Ź—Č–ĺ, –∑–į—Č–ĺ—ā–ĺ –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ĺ–į —ā–ĺ–≤–į —Ā–Ķ –ł–Ĺ–ī—É—Ü–ł—Ä–į/–ĺ—Ā–≤–ĺ–Ī–ĺ–∂–ī–į–≤–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ HbF. –Ę–ĺ–≤–į –Ķ –ī–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ā—ā–≤–ĺ, —á–Ķ –Ĺ–ĺ–ļ–į—É—ā–ł—Ä–į–Ĺ–Ķ—ā–ĺ –Ĺa –≥–Ķ–Ĺ–į —á—Ä–Ķ–∑ –Ņ–į—Ä—á–Ķ—ā–ĺ –ł–Ĺ—Ö–ł–Ī–ł—Ä–į—Č–į –†–Ě–ö - shmiR –Ķ –ł–∑–≥–ĺ–ī–Ĺ–ĺ –∑–į –Ľ–Ķ–ļ—É–≤–į–Ĺ–Ķ –Ĺ–į —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į—ā–į –į–Ĺ–Ķ–ľ–ł—Ź.
***
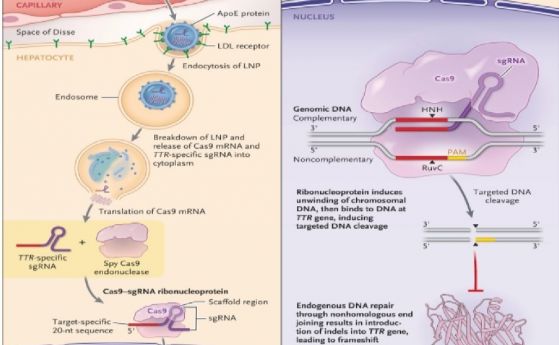
–ü—Ä–Ķ–ļ–ł—Ź—ā –ľ–Ķ—ā–ĺ–ī—ä—ā —Ā –ī–ĺ–Ī–į–≤—Ź–Ĺ–Ķ –Ĺ–į –≥–Ķ–Ĺ–į –∑–į –Ĺ–ĺ—Ä–ľ–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ, –ł–∑–Ņ–ĺ–Ľ–∑—É–≤–į–Ĺ –ĺ—ā –ļ–ĺ–ľ–Ņ–į–Ĺ–ł—Ź—ā–į Bluebirdbio, e —É—ā–≤—ä—Ä–ī–Ķ–Ĺ –≤ –ē–≤—Ä–ĺ–Ņ–į –ĺ—ā 2019 –∑–į –Ĺ—Ź–ļ–ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł —Ā –Ī–Ķ—ā–į-—ā–į–Ľ–į—Ā–Ķ–ľ–ł—Ź –ł —Ā—ä—Ä–Ņ–ĺ–≤–ł–ī–Ĺ–ĺ-–ļ–Ľ–Ķ—ā—ä—á–Ĺ–į –į–Ĺ–Ķ–ľ–ł—Ź –ł —Ā–Ķ –ĺ—á–į–ļ–≤–į –ī–į –Ņ–ĺ–Ľ—É—á–ł —Ä–į–∑—Ä–Ķ—ą–Ķ–Ĺ–ł–Ķ –ł –∑–į –ī–≤–Ķ—ā–Ķ –Ī–ĺ–Ľ–Ķ—Ā—ā–ł –≤ —Ā–Ľ–Ķ–ī–≤–į—Č–ł—ā–Ķ –≥–ĺ–ī–ł–Ĺ–ł –ĺ—ā –§–Ē–ź (Food and Drug Administration) –≤ –°–ź–©. –ė –≤ —ā–ĺ–≤–į –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł–Ķ –ľ–Ķ—ā–ĺ–ī—ä—ā –ł–ľ–į –Ņ—Ä–Ķ–ī–ł–ľ—Ā—ā–≤–ĺ –Ņ—Ä–Ķ–ī –ī—Ä—É–≥–ł—ā–Ķ –ī–≤–į –Ņ–ĺ–ī—Ö–ĺ–ī–į. –Ě–ĺ –ĺ—Č–Ķ –Ķ —Ä–į–Ĺ–ĺ –ī–į —Ā–Ķ –ĺ–Ī—Ź–≤–ł –Ņ–ĺ–Ī–Ķ–ī–ł—āe–Ľ –≤ —ā–į–∑–ł –Ĺ–į–ī–Ņ—Ä–Ķ–≤–į—Ä–į. –ü—Ä–Ķ–≤–ļ–Ľ—é—á–≤–į–Ĺ–Ķ—ā–ĺ –Ĺ–į —Ą–Ķ—ā–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–≤–į –Ĺ–į –ļ—Ä—ä–≤–Ĺ–ł—ā–Ķ –ļ–Ľ–Ķ—ā–ļ–ł –ī–į –≤—ä–∑—Ā—ā–į–Ĺ–ĺ–≤—Ź—ā –Ĺ–ĺ—Ä–ľ–į–Ľ–Ĺ–ł—ā–Ķ –Ĺ–ł–≤–į –Ĺ–į —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–į. –Ě–ĺ –Ĺ—Ź–ľ–į –ī–į–Ĺ–Ĺ–ł, —á–Ķ –Ņ—Ä–ł –Ņ–ĺ–ī—Ö–ĺ–ī–į –Ĺ–į Bluebird —Ā–Ķ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–∂–ī–į –ł–∑–Ľ–ł—ą–Ĺ–ĺ –ľ–Ĺ–ĺ–≥–ĺ —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ. –Ě–Ķ –Ķ –ł–∑–ļ–Ľ—é—á–Ķ–Ĺ–ĺ –ĺ–Ī–į—á–Ķ, –≤–ł—Ä—É—Ā—ä—ā, –Ĺ–ĺ—Ā–Ķ—Č –≥–Ķ–Ĺ–į –∑–į –Ĺ–ĺ—Ä–ľ–į–Ľ–Ĺ–ł—Ź —Ö–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ, –ī–į —Ā–Ķ –ł–Ĺ—ā–Ķ–≥—Ä–ł—Ä–į –Ĺ–į –Ĺ–Ķ–Ņ–ĺ–ī—Ö–ĺ–ī—Ź—Č–ĺ –ľ—Ź—Ā—ā–ĺ –≤ –≥–Ķ–Ĺ–ĺ–ľ–į –ł –ī–į –Ņ—Ä–Ķ–ī–ł–∑–≤–ł–ļ–į —Ä–į–ļ. –Ě–ĺ –ł —Ä–Ķ–ī–į–ļ—ā–ł—Ä–į–Ĺ–Ķ—ā–ĺ —Ā CRISPR-Cas9 –ľ–ĺ–∂–Ķ –Ņ–ĺ –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ –ī–į –ī–ĺ–≤–Ķ–ī–Ķ –ī–ĺ –ĺ–Ņ–į—Ā–Ĺ–ł –Ķ—Ą–Ķ–ļ—ā–ł –Ņ—Ä–ł –Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ –Ņ—Ä–ł—Ü–Ķ–Ľ–≤–į–Ĺ–Ķ. –Ē–ĺ—Ā–Ķ–≥–į –ĺ–Ī–į—á–Ķ –Ĺ—Ź–ľ–į –ł–Ĺ–ī–ł–ļ–į—Ü–ł–ł –∑–į —ā–ĺ–≤–į.
–Ě–ł—ā–ĺ –Ķ–ī–ł–Ĺ –ĺ—ā —ā–Ķ–∑–ł –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ĺ–ł –Ņ–ĺ–ī—Ö–ĺ–ī–ł –Ĺ–Ķ –ľ–ĺ–∂–Ķ –ī–į –Ņ–ĺ–ľ–ĺ–≥–Ĺ–Ķ –Ĺ–į –ľ–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ł –≤ –ľ–Ķ—Ā—ā–į –ļ–į—ā–ĺ –ź—Ą—Ä–ł–ļ–į –ł –ė–Ĺ–ī–ł—Ź , –ļ–ĺ–ł—ā–ĺ –Ĺ—Ź–ľ–į—ā –ī–ĺ—Ā—ā—ä–Ņ –ī–ĺ —ā–Ķ—Ö–Ĺ–ł—á–Ķ—Ā–ļ–ł —Ā–Ľ–ĺ–∂–Ĺ–ĺ –∑–ī—Ä–į–≤–Ķ–ĺ–Ņ–į–∑–≤–į–Ĺ–Ķ. –†–Ķ–∑—É–Ľ—ā–į—ā–ł—ā–Ķ —Ā–į –≤–Ņ–Ķ—á–į—ā–Ľ—Ź–≤–į—ą–ł, –Ĺ–ĺ –Ņ–ĺ—Ä–į–ī–ł –≤–ł—Ā–ĺ–ļ–į—ā–į —Ü–Ķ–Ĺ–į –Ĺ–Ķ —Ä–Ķ—ą–į–≤–į—ā –≥–Ľ–ĺ–Ī–į–Ľ–Ĺ–ł—Ź –∑–ī—Ä–į–≤–Ķ–Ĺ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ. Bluebirdbio –ł –ī—Ä—É–≥–ł—ā–Ķ –ļ–ĺ–ľ–Ņ–į–Ĺ–ł–ł –Ņ—Ä–ĺ–Ī–≤–į—ā –ī–į–Ľ–ł –≤–ľ–Ķ—Ā—ā–ĺ —Ā –≥—Ä—É–Ī–į —Ö–ł–ľ–ł–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź –Ī–ĺ–Ľ–Ĺ–ł—ā–Ķ –ļ–Ľ–Ķ—ā–ļ–ł –Ĺ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ľ–ĺ–≥–į—ā –ī–į —Ā–Ķ –ł–∑—á–ł—Ā—ā—Ź—ā —á—Ä–Ķ–∑ –į–Ĺ—ā–ł—ā–Ķ–Ľ–į. –Ě–į—Ü–ł–ĺ–Ĺ–į–Ľ–Ĺ–ł—ā–Ķ –ė–Ĺ—Ā—ā–ł—ā—É—ā–ł –Ņ–ĺ –∑–ī—Ä–į–≤–Ķ–ĺ–Ņ–į–∑–≤–į–Ĺ–Ķ (NIH) –ł —Ą–ĺ–Ĺ–ī–į—Ü–ł—Ź—ā–į –Ĺ–į –Ď–ł–Ľ –ł –ú–Ķ–Ľ–ł–Ĺ–ī–į –ď–Ķ–Ļ—ā—Ā –ĺ–Ī—Ź–≤–ł—Ö–į –ľ–ł–Ĺ–į–Ľ–į—ā–į –≥–ĺ–ī–ł–Ĺ–į, —á–Ķ –Ņ–Ľ–į–Ĺ–ł—Ä–į—ā –ī–į –≤–Ľ–ĺ–∂–į—ā –Ņ–ĺ —Ā—ā–ĺ –ľ–ł–Ľ–ł–ĺ–Ĺ–į –ī–ĺ–Ľ–į—Ä–į –∑–į —Ä–į–∑–≤–ł–≤–į–Ĺ–Ķ –Ĺ–į —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł, –ļ–ĺ–ł—ā–ĺ –ī–į –ľ–ĺ–ī–ł—Ą–ł—Ü–ł—Ä–į—ā —Ā—ā–≤–ĺ–Ľ–ĺ–≤–ł—ā–Ķ –ļ—Ä—ä–≤–Ĺ–ł –ļ–Ľ–Ķ—ā–ļ–ł —Ā –ł–Ĺ–∂–Ķ–ļ—ā–ł—Ä–į–Ĺ–Ķ –Ĺ–į –≥–Ķ–Ĺ-—Ä–Ķ–ī–į–ļ—ā–ł—Ä–į—Č–ł—ā–Ķ ‚Äě—É—Ä–Ķ–ī–ł‚Äú –ī–ł—Ä–Ķ–ļ—ā–Ĺ–ĺ –≤ —ā—Ź–Ľ–ĺ—ā–ĺ. –Ę–ĺ–≤–į —Č–Ķ –Ķ —ā—Ä—É–ī–Ĺ–į –∑–į–ī–į—á–į –∑–į –≥–Ķ–Ĺ–Ĺ–ł—ā–Ķ –ł–Ĺ–∂–Ķ–Ĺ–Ķ—Ä–ł, –Ĺ–ĺ —ā–Ķ –ĺ–Ņ—ā–ł–ľ–ł—Ā—ā–ł—á–Ĺ–ĺ –≤—Ź—Ä–≤–į—ā, —á–Ķ —Ä–į–Ĺ–ĺ –ł–Ľ–ł –ļ—ä—Ā–Ĺ–ĺ —ā–ĺ–≤–į —Č–Ķ —Ā—ā–į–Ĺ–Ķ.
–õ–ł—ā–Ķ—Ä–į—ā—É—Ä–į:
1. Frangoul et al N Engl J Med 2021;384:252-60. DOI: 10.1056/NEJMoa2031054 –≤–ł–ī–Ķ–ĺ: https://www.youtube.com/watch?v=d6uvaPSr0Rg&ab_channel=AndriyNemirov
2. Esrick, E. B.New England Journal of Medicine 2021 January 21, 384 (3): 205-215 –≤–ł–ī–Ķ–ĺ: https://www.youtube.com/watch?v=hpePSHTjojg&t=9s&ab_channel=Oncoletter
3. Kaiser J. Science  11 Dec 2020:Vol. 370, Issue 6522, pp. 1254-1255. DOI:10.1126/science.370.6522.1254
–ź–≤—ā–ĺ—Ä—ä—ā –ö–ĺ–Ĺ—Ā—ā–į–Ĺ—ā–ł–Ĺ –ß–ł–Ņ–Ķ–≤ –Ķ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ķ–Ĺ –ł –ļ–Ľ–Ķ—ā—ä—á–Ķ–Ĺ –Ī–ł–ĺ–Ľ–ĺ–≥ –ĺ—ā –£–Ĺ–ł–≤–Ķ—Ä—Ā–ł—ā–Ķ—ā–į –°—ā–ĺ–Ĺ–ł –Ď—Ä—É–ļ –≤ –Ě—é –ô–ĺ—Ä–ļ.
–ě—Č–Ķ –Ņ–ĺ —ā–Ķ–ľ–į—ā–į
–Ė–ł–≤–ĺ—ā—ä—ā
–ď–Ķ–Ĺ–Ĺ–ł—Ź—ā —Ä–Ķ–ī–į–ļ—ā–ĺ—Ä CRISPR –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į –†–Ě–ö –ļ–į—ā–ĺ –ĺ—Ä—ä–∂–ł–Ķ –∑–į –Ņ–ĺ—ā–ł—Ā–ļ–į–Ĺ–Ķ –Ĺ–į –ļ–ĺ—Ä–ĺ–Ĺ–į–≤–ł—Ä—É—Ā–ł—ā–Ķ –ł –≥—Ä–ł–Ņ–Ĺ–ł—ā–Ķ –≤–ł—Ä—É—Ā–ł
–ú–Ķ–ī–ł—Ü–ł–Ĺ–į
–ď–Ķ–Ĺ–Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—Ź —Ā CRISPR —á—Ä–Ķ–∑ —ā—Ä–į–Ĺ—Ā—Ą—É–∑–ł—Ź –Ĺ–į –†–Ě–ö –≤ –ļ—Ä—ä–≤—ā–į















–ö–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł
–ú–ĺ–Ľ—Ź, —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–į–Ļ—ā–Ķ —Ā–Ķ –ĺ—ā T–£–ö!
–ź–ļ–ĺ –≤–Ķ—á–Ķ –ł–ľ–į—ā–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł—Ź, –Ĺ–į—ā–ł—Ā–Ĺ–Ķ—ā–Ķ –Ę–£–ö!
–Ě—Ź–ľ–į –ļ–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł –ļ—ä–ľ —ā–į–∑–ł –Ĺ–ĺ–≤–ł–Ĺ–į !
–ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł –ļ–ĺ–ľ–Ķ–Ĺ—ā–į—Ä–ł
dolivo
–ó–Ķ–ľ–Ĺ–į—ā–į —Ź–Ī—ä–Ľ–ļ–į: —Ā—ā–į—Ä–į –ļ—É–Ľ—ā—É—Ä–į –∑–į –Ĺ–ĺ–≤–ł—ā–Ķ –ļ–Ľ–ł–ľ–į—ā–ł—á–Ĺ–ł –≤—Ä–Ķ–ľ–Ķ–Ĺ–į
dolivo
–ó–Ķ–ľ—Ź—ā–į –Ņ–ĺ—ā—ä–ľ–Ĺ—Ź–≤–į. –ö–į–ļ–≤–ĺ –ĺ–∑–Ĺ–į—á–į–≤–į —ā–į–∑–ł —ā—Ä–Ķ–≤–ĺ–∂–Ĺ–į –ļ–Ľ–ł–ľ–į—ā–ł—á–Ĺ–į —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—Ź –∑–į –Ī—ä–ī–Ķ—Č–Ķ—ā–ĺ?
Nikor
–Ě–į 30 —Ā–Ķ–Ņ—ā–Ķ–ľ–≤—Ä–ł 1928 –Ķ –ĺ—ā–ļ—Ä–ł—ā –Ņ–Ķ–Ĺ–ł—Ü–ł–Ľ–ł–Ĺ—ä—ā
–ü—Ä–ĺ—Ā—ā –ß–ĺ–≤–Ķ–ļ
–Ě–ĺ–≤–ĺ –ĺ–Ī—Ź—Ā–Ĺ–Ķ–Ĺ–ł–Ķ –∑–į –≥–ł–≥–į–Ĺ—ā—Ā–ļ–ł—ā–Ķ –Ķ–ļ—Ā–Ņ–Ľ–ĺ–ī–ł—Ä–į—Č–ł –ļ—Ä–į—ā–Ķ—Ä–ł –≤ –°–ł–Ī–ł—Ä